
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Побудова та аналіз діаграм стану обмежено розчинних рідинСодержание книги
Поиск на нашем сайте
Мета роботи – ознайомитися з принципами фізико-хімічного аналізу і навчитися будувати за експериментальними даними діаграми стану двохкомпонентних рідких систем з обмеженою розчинністю компонентів. Теоретичні відомості Для аналізу поведінки систем, які складаються з декількох фаз застосовують фізико-хімічний метод, який ґрунтується на дослідженні зв’язків між складом системи (або іншими параметрами її стану) та її властивостями. Однорідні частини гетерогенної системи називають фазою. Фаза – це сукупність гомогенних частин системи, однакових у всіх точках за складом та фізико-хімічними властивостями та розмежованих одна від одної поверхнею розділу. Кожна з фаз гетерогенної системи може складатися з кількох речовин. Речовина при зміні тиску та температури може переходити з одного агрегатного стану в інший. Ці переходи називають фазовими переходами. Фазове перетворення(фазовий перехід) – процес переходу речовини з однієї фази в іншу, в якому не відбувається хімічних реакцій. Це такі процеси як випаровування, сублімація, плавлення та ін. Характеристики систем з фазовими переходами прийнято відображати у вигляді графічної залежності стану системи від зовнішніх умов – так званих діаграм стану. Аналіз діаграм стану дозволяє визначити кількість фаз в системі, межі їх існування, характер взаємодії компонентів. Діаграми стану також дають можливість виявити наявність хімічних сполук в системі, склад цих сполук, температуру фазових перетворень тощо. Якщо в системі досліджується залежність температури плавлення від складу, одержують діаграму плавкості. Якщо криві будують в координатах електрична провідність – склад, в'язкість – склад або температура змішування двох рідин – склад, отримують відповідно діаграму електричної провідності, в'язкості або розчинності. Будь-яка точка на діаграмі стану (т. з. фігуративна точка) відповідає певному стану системи з визначеними значеннями параметрів стану. Теоретична основа фізико-хімічного аналізу – правило фаз Гіббса. Правило фаз Гіббса: у термодинамічній системі, що перебуває у стані рівноваги, на яку з усіх можливих факторів діють лише температура та тиск, число термодинамічних ступенів вільності визначається різницею між кількістю компонентів К і кількістю фаз Ф плюс два. С=К–Ф+2 (2.1) де С – число степенів вільності – це кількість незалежних термодинамічних параметрів системи, які можна одночасно та незалежно змінювати, не викликаючи зникнення або появи нових фаз; К – кількість незалежних компонентів системи – це мінімальна кількість незалежних складових, за допомогою яких можна виразити склад любої фази даної системи; Ф – кількість фаз (число однорідних частин системи, які мають визначений хімічний склад і термодинамічні властивості, відокремлених від інших фаз поверхнею поділу); 2 – число зовнішніх чинників, які обумовлюють існування системи, наприклад, тиск і температура. Якщо один із цих чинників сталий, замість "2" в рівнянні пишуть "1". Система з одним ступенем вільності називається моноваріантною. Якщо число ступенів вільності дорівнює нулю, система називається нонваріантною. Таким чином, число ступенів вільності за правилом фаз Гіббса можна виразити як різницю між кількістю компонентів і фаз плюс 2. Число 2 показує, що всі фази системи перебувають в рівновазі за двох заданих параметрів: температури і тиску. В цьому випадку повну об'ємну діаграму стану будують в координатах температура – тиск – склад. Якщо процес відбувається за сталого тиску, будують пласку діаграму стану в координатах температура–склад (Т – N) і правило фаз Гіббса запишеться так: С=К–Ф+1. Температура, за якої фази перебувають в рівновазі, є основною характеристикою фазового перетворення. Обмежена взаємна розчинність двох рідин спостерігається у системах зі значним відхиленням від ідеальності. Така розчинність компонентів системи залежить від температури, проте вплив останньої на різні системи неоднаковий. В одних системах взаємна розчинність рідин збільшується з підвищенням температури і при цьому склад двох рівноважних фаз зближується. За деякої температури, яку називають критичною температурою розчинення (КТР), склад обох рівноважних фаз стає однаковим і досягається повна гомогенність системи. При обмеженій розчинності двох рідин утворюється двошарова система: верхній і нижній шари мають різний склад і становлять насичений розчин за даної температури однієї рідини в іншій. Між ними існує чітка межа поділу. Зміна взаємної розчинності двох рідин значною мірою залежить від зміни температури. З ростом температури збільшується кількість молекул з підвищеним запасом енергії руху, які здатні здійснити роботу переходу через межу поділу фаз. Отже, збільшується і взаємна розчинність рідин. Таким чином, склад спряжених розчинів буде дедалі зближуватися і за якоїсь температури зрівняється. Ця температура, починаючи з якої і вище рідини необмежено розчиняються одна в одній, називається верхньою критичною температурою розчинення. Системи, що складаються із двох обмежено розчинних рідин, взаємна розчинність яких зростає із підвищенням температури, називаються системами з верхньою КТР. До них належать система вода–анілін, вода–фенол, вода–нітробензол. Залежність взаємної розчинності рідин від температури за сталого тиску відображають на діаграмах стану в координатах температура–склад.
Будь-яка фігуративна точка, що лежить всередині гетерогенної області, наприклад точка 0, відображає стан двохфазної рівноважної системи з одним ступенем вільності (С=2–2+1=1). Склади рівноважних рідких фаз знаходяться за правилом з'єднувальної прямої (правило важеля), відповідно з яким фігуративні точки, що відображають склад усієї системи у цілому і склади окремих рівноважних фаз, лежать на одній прямій – ноді (ізотерма). Так, суміш складу x, відображена на діаграмі фігуративною точкою О, розшаровується на дві рівноважні фази а і b(пряма ав – нода) складу x1, і х2. Характерна особливість систем, що розшаровуються, полягає у тому, що зі зміною складу всієї системи при даній температурі склади окремих рівноважних фаз залишаються без змін, а змінюється лише їх кількісне співвідношення. Зі зміною температури склади рівноважних рідких фаз змінюються. В точці К розчини стають тотожними, система стає гомогенною. Система, що відображена на діаграмі точкою К, за умови сталого тиску (P=const) буде безваріантною (С=2–З+1=0). Для визначення положення критичної точки К на діаграмі застосовується правило Б.Ф. Алексєєва ( правило важеля ), відповідно до якого середини нод (точки g та l), що знаходяться між точками, які відображають склади рівноважних фаз (x1, і х2) лежать на одній прямій (лінія g, l), спрямованій до критичної точки K.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 740; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |

 Рис. 2.1 Діаграма взаємної розчинності води й аніліну за Р=сonst
Рис. 2.1 Діаграма взаємної розчинності води й аніліну за Р=сonst
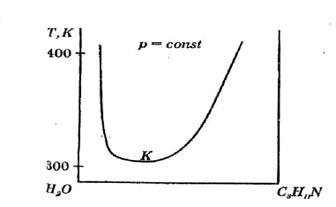 Рис. 2.2. Діаграма стану вода–триметилпіридин з нижньою критичною температурою розчинення
Рис. 2.2. Діаграма стану вода–триметилпіридин з нижньою критичною температурою розчинення
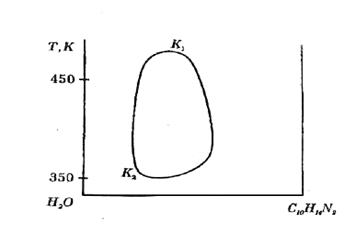 Рис. 2.3 Діаграма стану система вода–нікотин з верхньою та нижньою критичними температурами розчинення (Р= сonst)
Рис. 2.3 Діаграма стану система вода–нікотин з верхньою та нижньою критичними температурами розчинення (Р= сonst)



