
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Національний університет харчових технологійСодержание книги
Поиск на нашем сайте
ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ МЕТОДИЧНІ ВКАЗІВКИ До виконання лабораторних робіт для студентів напряму 6.051701 "Харчові технології та інженерія" денної та заочної форм навчання Всі цитати, цифровий та фактичний матеріал, бібліографічні відомості перевірені. Написання одиниць відповідає стандартам Підписи авторів_______________ ________________________2011 р.
СХВАЛЕНО на засіданні кафедри фізичної і колоїдної хімії Протокол № 15 від 07.06.2011 р.
Київ НУХТ 2011 Фізична та колоїдна хімія: Метод. вказівки до викон. лаборатор. робіт для студ. напряму 6.051701 «Харчові технології та інженерія» ден. та заоч. форм навч. / Уклад.: О.В. Грабовська, О.М. Мірошников, О.В. Подобій, Л.С. Воловик, Є.І. Ковалевська– К.: НУХТ, 2011. – 89 с.
Рецензент О.М. Полумбрик, д-р. хім. наук
Укладачі: О.В. Грабовська, д-р тех. наук О.М. Мірошников, канд. хім. наук О.В. Подобій, канд. тех. наук Л.С. Воловик, канд. хім. наук Є.І. Ковалевська, канд. хім. наук
Відповідальна за випуск О.В.Грабовська, д-р тех. наук, проф.
Видання подається в авторський редакції
Вступ
Фізична хімія – наука, що пояснює хімічні явища і встановлює їхні закономірності на основі загальних принципів фізики та хімії. Вона охоплює всі питання теорії хімічних процесів і розглядає вплив фізичних параметрів на хімічні перетворення і фізичні властивості речовин. Предметом дисципліни є вивчення законів протікання хімічних процесів у часі, теплових ефектів, що їх супроводжують, законів хімічної рівноваги, будови атомів, молекул і речовин на молекулярному рівні та вивчення дисперсного стану речовини, поверхневих явищ в дисперсних системах, ролі цих явищ у визначенні фізико-хімічних властивостей колоїдних розчинів. Фізична та колоїдна хімія є базою для всіх технологічних дисциплін. Мета дисципліни – навчити студентів розуміти основи фізико-хімічних процесів, що відбуваються при одержанні харчових продуктів та в технології харчування, а також використовувати класичні та нові фізико-хімічні методи дослідження структури та властивостей речовин, основні положення хімії поверхневих явищ для характеристики технологічних процесів у харчовій промисловості. Згідно вимог освітньо-професійної програми вищої освіти за професійним спрямуванням “Харчові технології та інженерія” фізична та колоїдна хімія вивчається після неорганічної, аналітичної та органічної хімії і завершує хімічну освіту бакалавра. Останнім визначаються завдання, що стоять перед дисципліною в процесі підготовки фахівців. По-перше, ця наука об’єднує та поглиблює фундаментальні знання основних законів природознавства і сприяє формуванню різноманітного підходу до пояснення явищ природи. По-друге, ця дисципліна є теоретичною основою всіх технологічних виробництв в харчовій промисловості. Внаслідок вивчення фізичної та колоїдної хімії бакалавр отримує цілісне уявлення щодо процесів та явищ, які відбуваються в неживій та живій природі; розуміє можливості сучасних наукових методів пізнання природи, володіє ними для рішення конкретних завдань, що виникають при виконанні професійних функцій. Одним з основних завдань дисципліни є навчити студентів розв’язувати завдання ефективного керування виробництвом, прогнозувати перебіг і результат процесу, а також зміну умов, щоб процес відбувався у бажаному напрямі з найменшими витратами. Викладання цієї дисципліни базується на знаннях, що набули бакалаври з курсів вищої математики, фізики та всього циклу хімічних дисциплін, які вивчаються з використанням сучасних досягнень науки, мають практичну направленість і підтверджуються прикладами із різноманітних технологічних процесів харчової промисловості. З метою кращого засвоєння теоретичних основ дисципліни слід використовувати різні наочні посібники, технічні засоби навчання, комп’ютерну техніку. Лабораторні роботи повинні виконуватися при вивченні відповідної теми, що сприяє кращому засвоєнню теоретичного матеріалу і надає можливість студентам ознайомитися з фізико-хімічними процесами, які лежать в основі одержання та дослідження складу і властивостей продуктів харчування, необхідними приладами, методикою проведення лабораторних досліджень та навчитися самостійно аналізувати системи і виконувати необхідні розрахунки. Для самостійної підготовки студентів передбачені теоретичні відомості на початку кожної лабораторної роботи та питання для самоперевірки знань. Лабораторна робота № 1
Визначення інтегральної теплоти розчинення солі Мета роботи – ознайомитися з принципом калориметричних вимірювань, навчитися експериментально визначати теплові ефекти хімічних та фізико-хімічних процесів. Теоретичні відомості Термохімія є розділом термодинаміки, що вивчає теплові ефекти хімічних реакцій, фазових перетворень, процесів розчинення, адсорбції, змочування, набухання та ін. Теоретична основа термохімії – перший закон термодинаміки. Це закон збереження і перетворення енергії, який стверджує, що теплота Q, яка надана системі, витрачається на збільшення її внутрішньої енергії U і на виконання системою роботи проти зовнішніх сил А. Для будь-якого елементарного термодинамічного процесу перший закон термодинаміки записується у вигляді:
Рівняння (1.1) є математичним виразом першого начала термодинаміки. Величина dU – повний диференціал величини енергії. Внутрішня енергія характеризує загальний запас енергії системи, тобто енергію поступального і обертального руху молекул, енергію коливань атомів, що входять до складу молекули, енергію обертання електронів навколо ядер і ядерну енергію. Коли система під дією різних чинників переходить із одного стану в інший, зміна її внутрішньої енергії ΔU не залежить від шляху, яким система перейшла від початкового до кінцевого стану. Функції, заміна яких не залежить від способу проведення процесу, називаються функціями стану. Внутрішня енергія є функцією стану термодинамічної системи. Теплота та робота – різні форми передачі енергії, що характеризують визначений процес, і, в загальному вигляді, не можуть бути функціями стану, тому в рівнянні (1.1) вони виражені не повним диференціалом, а нескінченно малою кількістю теплоти та роботи. Якщо процес виконується за сталого об'єму V=const (ізохорний процес), робота проти зовнішніх сил (робота розширення) відсутня і рівняння (1.1) можна записати у вигляді:
Оскільки U – функція стану, Q v також є функцією стану. Якщо процес йде за умови сталого тиску Ρ=const (ізобарний процес), згідно з (1.3) в системі можливе виконання роботи розширення:
Після інтегрування рівняння (1.3) отримуємо:
Величина U+P∙V=H називається ентальпією. Зміна ентальпії, як і зміна внутрішньої енергії, не залежить від шляху процесу і є функцією стану. Зміну ентальпії відносять до одного моля речовини і вимірюють у Дж/моль. Отже Qр також є функцією стану
З (1.5) видно, що кількість теплоти, наданої системі за сталого тиску, дорівнює зміні ентальпії даної системи. Як випливає з (1.2) і (1.5), теплота процесу за умови V=const і Ρ=const залежить тільки від різниці енергії кінцевого і початкового стану системи. Закон Гесса є основним законом термохімії і формулюється так: якщо з даних вихідних речовин можна одержати задані кінцеві продукти різними шляхами, сумарна теплота процесу для всіх шляхів буде одна. Цей закон є цілком правильним лише для процесів, що проходять при сталому об'ємі (Qv= D U) або тиску (Qp = D Н) за сталої температури. Тепловим ефектом реакції називається кількість теплоти, що виділяється або поглинається при хімічній реакції за сталого об’єму та тиску, а також при однаковій температурі початкових і кінцевих речовин. Для порівняння теплових ефектів їх приводять до однакових умов. З цією метою введено поняття стандартних ефектів, значення яких вимірюють при T = 298 K і P = 101,325 кПа. Стандартні теплові ефекти позначають Згідно закону Гесса тепловий ефект процесу не залежить від шляхів переходу або проміжних стадій, а визначається лише початковим і кінцевим станами системи. Цей закон дозволяє розрахувати теплові ефекти процесів, які експериментально визначити немає можливості, через табличні значення теплот утворення, згоряння, розчинення. Теплота утворення хімічної сполуки – це кількість тепла, що поглинається або виділяється при утворенні одного моля цієї сполуки із простих речовин при стандартних умовах. Теплоту утворення простих речовин умовно приймають рівною нулю. Через те що більшість хімічних реакцій проходить за сталого тиску, для характеристики теплових ефектів використовують ентальпію ΔН. Ентальпія – це теплота утворення 1 моль сполуки з відповідних простих речовин за стандартних умов. Розчинення речовини супроводжується виділенням або поглинанням теплоти, що характеризується інтегральним або диференціальним тепловим ефектом. Інтегральною теплотою розчинення (ΔНр) називають теплоту розчинення 1 моль речовини з утворенням розчину заданої моляльності (моляльна концентрація характеризується числом молів речовини, розчиненої в 1000 г розчинника). Диференціальна теплота розчинення – це теплота розчинення 1 моль речовини в нескінченно великій кількості розчину постійної концентрації. Тепловий ефект при розчиненні кристалічної солі (Δ Нр) визначається двома стадіями. Перша стадія характеризується ендотермічним процесом (E) руйнування кристалічних ґраток солі і віддалення іонів на значну відстань від поверхні кристалу. Друга - екзотермічним процесом (Δ Нг) гідратації (сольватації) іонів. Отже Δ Нр=Е+ Δ Нг (1.6) Для розрахунку теплового ефекту розчинення солі була введена додаткова функція – теплоємність термодинамічної системи, яка визначається рівнянням:
Тобто, теплоємність визначається такою величиною теплоти процесу, при якій температура системи змінюється на 1ºС.
після інтегрування (1.8) отримаємо:
Завдання на виконання роботи
1. Визначити сталу калориметра за азотнокислим калієм. 2. Визначити інтегральну теплоту розчинення невідомої солі.
Прилади, лабораторний посуд та реактиви
Лабораторна робота № 1.1
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 350; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.37.211 (0.008 с.) |

 (1.1)
(1.1)
 (1.2)
(1.2) (1.3)
(1.3) (1.4)
(1.4) (1.5)
(1.5)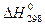 .
. (1.7)
(1.7) (1.8)
(1.8)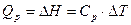 (1.9)
(1.9)



