
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневий натяг розчинів оцтової кислотиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
2. Ізотерму адсорбції Гіббса за ізотермою поверхневого натягу розраховують та будують на підставі таких міркувань. Зв’язок між гіббсівською адсорбцією, концентрацію ПАР та зміною поверхневого натягу з концентрацією встановлюється рівнянням Гіббса
Кожній концентрації С на кривій ізотерми поверхневого натягу (рис. 7.4) відповідає своє значення похідної
або
3. Після підстановки Z у рівняння Гіббса (7.14) отримуємо рівняння для розрахунку значень адсорбції (Г) ПАР у поверхневому моношарі на межі розділу розчин – повітря:
Рис. 7.4. Ізотерма поверхневого натягу розчинів оцтової кислоти у воді та її графічне опрацювання
Отже, кожному значенню концентрації на ізотермі поверхневого натягу відповідає свій відрізок Z і відповідно своє значення Г. Ці значення заносять до табл. 7.3. Таблиця 7.3 Розрахунок значень адсорбції Гіббса (R =8,314 Дж/(моль×К))
4. Побудову ізотерми адсорбції Гіббса проводять у координатах (Г, моль/м2) =f(С, моль/л). 5.Для розрахунку ємності моношару 6. Будують графік у координатах 7. Розраховують довжину молекули ПАР та її "посадкову площу" за рівняннями (7.10) та (7.11).
Питання для самоперевірки
1. Дати визначення поверхневого натягу. Фізичний зміст сили поверхневого натягу та одиниці вимірювання. 2. Поверхневий натяг чистих рідин. Як залежить поверхневий натяг від температури? 3. Чим пояснюється сферична форма крапель рідини? 4. Методи вимірювання поверхневого натягу. 5. Дати визначення поняттям “адсорбція” та “поверхнево-активна речовина”. 6. Наведіть та проаналізуйте основне рівняння ізотерми адсорбції Гіббса. 7. Що таке поверхнева активність і як її визначити? 8. Описати метод побудови ізотерми адсорбції Гіббса за ізотермою поверхневого натягу. 9. Поняття про ПАР: приклади; будова молекули ПАР. 10. Дайте характеристику поверхнево-активним і поверхнево-інактивним речовинам. 11. Сформулюйте та поясніть правило Дюкло–Траубе. 12. Рівняння Ленгмюра. Як графічно визначити сталі рівняння Ленгмюра? 13. Розрахунок граничної адсорбції. 14. Розрахунок довжини молекули ПАР та площі, що її займає ця молекула на поверхні поділу фаз.
Лабораторна робота № 8
АДСОРБЦІЯ НА МЕЖІ ПОДІЛУ ТВЕРДЕ ТІЛО – РІДИНА. ОБЧИСЛЕННЯ ПИТОМОЇ ПОВЕРХНІ АДСОРБЕНТУ Мета роботи – навчитися експериментально визначати адсорбцію ПАР на активному вугіллі та розраховувати питому поверхню адсорбенту.
Теоретичні відомості Адсорбція – це процес накопичення молекул розчиненої речовини або газу на поверхні поділу фаз. Він супроводжується енергетичною зміною системи – виділенням або поглинанням теплоти. Цей процес відбувається самовільно, оскільки в результаті його проходження знижується поверхневий натяг на межі розділу фаз і зменшується вільна поверхнева енергія. Речовина, на поверхні якої відбувається адсорбція, називається адсорбентом, а речовина, що накопичується – адсорбтивом (адсорбатом). Залежно від агрегатного стану адсорбенту та адсорбтиву розрізняють три типи адсорбції: адсорбцію газу на поверхні твердого тіла, розчиненої речовини на межі розділу рідина – газ та адсорбцію розчиненої речовини на межі тверде тіло – розчин. Графічна залежність кількості адсорбованої речовини від рівноважного тиску Г=f(P) або від концентрації Г=f(С) при сталій температуріназивається ізотермою адсорбції. Нагромадження молекул на твердому адсорбенті може бути чисто фізичним процесом (фізична адсорбція) або супроводжуватись хімічною реакцією на поверхні адсорбенту – хімічна адсорбція (хемосорбція). Хемосорбція – хімічний процес, який потребує значної енергії активації, через це збільшення температури сприяє хемосорбції. І.Ленгмюр створив і обгрунтував теорію мономолекулярної адсорбції газів на твердому адсорбенті, припустивши, що активні центри рівномірно розподілені на поверхні і адсорбція локалізована. Рівняння ізотерми адсорбції Ленгмюрамає вигляд
де Г – адсорбція, моль/м2; Г∞ – гранична адсорбція (ємність моношару); А – стала; С – концентрація, моль/л. Для визначення сталих А і Г∞ рівняння Ленгмюра для адсорбції можна привести до рівняння прямої і записати у вигляді:
Пряма, побудована в координатах С /Г=f(С) не проходить через початок координат (рис. 7.1) і відтинає на вісі відрізок, що дорівнює При адсорбції з розчинів на твердих адсорбентах прийнято розрізняти молекулярну адсорбцію, тобто адсорбцію неелектролітів, коли речовина адсорбується у молекулярному стані, та іонну адсорбцію, коли вибірково адсорбується один з іонів електроліту. При молекулярній адсорбції молекули розчиненої речовини і розчинника здатні до адсорбції на твердій поверхні і можуть адсорбуватись одночасно. Переважна адсорбція тих чи інших молекул буде визначатися їх здатністю зменшувати вільну поверхневу енергію на межі розділу адсорбент – розчин. Речовина, яка більшою мірою знижує значення поверхневої енергії s адсорбенту, буде адсорбуватися переважно в більших кількостях. Згідно теорії Ленгмюра адсорбція на твердих адсорбентах проходить не на всій поверхні, а тільки на адсорбційно-активних центрах з надлишком вільної поверхневої енергії. Тому, необхідно підбирати адсорбент, який не взаємодіє з розчинником. Молекулярна адсорбція залежить від природи адсорбенту в тому середовищі, в якому розчинені молекули адсорбтиву. Полярні адсорбенти – глина, силікагель, алюмогель, цеоліти – добре змочуються водою. Такі адсорбенти краще адсорбують поверхнево-активні речовини з вуглеводневих (неполярних) середовищ, оскільки взаємодія між полярним адсорбентом і вуглеводневим середовищем незначна. Неполярні адсорбенти – вугілля, тальк – краще адсорбують речовини з водних розчинів. Такий вплив на адсорбцію природи адсорбенту, адсорбтиву і середовища підпорядковується правилу вирівнювання полярностей Ребіндера – процес адсорбції йде в бік вирівнювання полярностей фаз ітим сильніше,чимбільша початкова різниця полярностей. Іншими словами – речовина буде адсорбуватись на поверхні адсорбенту, якщо своєю присутністю в поверхневому шарі вона зменшує різницю полярностей фаз. Через це для адсорбції, наприклад, оцтової кислоти з води слід використовувати неполярний адсорбент – вугілля, тальк; а для адсорбції її з неполярного середовища – бензолу, толуолу – полярний адсорбент – силікагель, алюмогель. Адсорбцію на порошкоподібному адсорбенті можна розрахувати таким чином. Якщо в розчин об’ємом V з початковою концентрацією ПАР С0 всипати пористий порошкоподібний адсорбент (активоване вугілля) масою m, то частина ПАР із розчину буде адсорбуватися на твердій поверхні. В результаті концентрація речовини в розчині знизиться до С, величина надлишкової (гіббсівської) адсорбції буде:
Дане рівняння показує кількість ПАР, що адсорбувалися на поверхні твердого тіла. Адсорбція буде виражатися в моль/кг. Орієнтація молекул ПАР на межі розділу тверде тіло – рідина буде відбуватися згідно правила вирівнювання полярностей Ребіндера. На межі вугілля (неполярна фаза) з водою (полярна фаза) адсорбційний шар молекул ПАР орієнтується гідрофільною частиною до рідини. Адсорбційний шар молекул ПАР вкриває тверду поверхню і надає їй полярні властивості (Рис.8.1,а). Таким чином, границя поділу неполярне тверде тіло – полярна рідина в результаті адсорбції замінюється на границю поділу полярна частина адсорбційного шару на твердій поверхні – полярна рідина. Відбулося вирівнювання полярностей фаз: неполярно – полярна границя стала полярно – полярною.
Рис. 8.1. Схема орієнтації молекул ПАР на межі фаз різної природи
Розглянемо другий приклад, коли гідрофільна поверхня твердого тіла (силікагель) контактує з неполярною рідиною (бензол) (рис. 8.1,б). При цьому молекули ПАР орієнтуються навпаки – гідрофобна, неполярна, вуглеводнева частина повернена в сторону неполярного бензолу, а гідрофільна – в сторону полярного силікагелю. І вихідна границя поділу полярне тверде тіло – неполярна рідина в результаті адсорбції замінюється на неполярний адсорбційний шар твердої поверхні – неполярна рідина. Отже всі полярні гідрофільні поверхні повинні добре адсорбувати ПАР з неполярних або слабополярних рідин і, навпаки, неполярні гідрофобні поверхні добре адсорбують ПАР з полярних рідин. З ростом молекулярної маси ПАР здатність до адсорбції зростає, тобто тут також діє правило Траубе. У гомологічному ряду органічних речовин /кислот, спиртів/ адсорбційна здатність збільшується у міру зростання довжини вуглеводневого ланцюга. Значення адсорбції при переході від одного гомолога до наступного збільшується в 1,5 рази. На молекулярну адсорбцію впливає пористість адсорбенту та розмір його пор.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 781; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.219.131 (0.011 с.) |

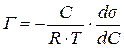 . (7.14)
. (7.14)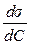 , що входить у рівняння Гіббса і використовується для розрахунку адсорбції Г. За методом графічного розв’язування ізотерми поверхневого натягу
, що входить у рівняння Гіббса і використовується для розрахунку адсорбції Г. За методом графічного розв’язування ізотерми поверхневого натягу  до цієї кривої в п’яти точках, що відповідають п’яти концентраціям робочих розчинів ПАР у воді, проводять дотичні та горизонтальні лінії до перетину з віссю ординат (рис. 7.4). Довжина відрізка BD у трикутнику ABD дорівнює довжині відрізка ОМ і відповідає концентрації розчину оцтової кислоти 0,250 моль/л. Позначивши відрізок АВ літерою Z та навівши його в одиницях поверхневого натягу, одержуємо:
до цієї кривої в п’яти точках, що відповідають п’яти концентраціям робочих розчинів ПАР у воді, проводять дотичні та горизонтальні лінії до перетину з віссю ординат (рис. 7.4). Довжина відрізка BD у трикутнику ABD дорівнює довжині відрізка ОМ і відповідає концентрації розчину оцтової кислоти 0,250 моль/л. Позначивши відрізок АВ літерою Z та навівши його в одиницях поверхневого натягу, одержуємо: (7.15)
(7.15) . (7.16)
. (7.16) . (7.17)
. (7.17)
 , моль/м2, користуються рівнянням Ленгмюра, приведеного до рівняння прямої (7.13).
, моль/м2, користуються рівнянням Ленгмюра, приведеного до рівняння прямої (7.13). (рис. 7.1)і визначають значення граничної адсорбції
(рис. 7.1)і визначають значення граничної адсорбції  , моль/м2.
, моль/м2. (8.1)
(8.1) (8.2)
(8.2) . Константа А характеризує поверхневу активність адсорбтиву; Г∞ визначається за котангенсом кута нахилу прямої до вісі абсцис: Г∞=ctga.
. Константа А характеризує поверхневу активність адсорбтиву; Г∞ визначається за котангенсом кута нахилу прямої до вісі абсцис: Г∞=ctga.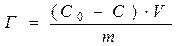 (8.3)
(8.3)



