
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота № 2 «поверхневий натяг.Содержание книги
Поиск на нашем сайте АДСОРБЦІЯ НА РІДКІЙ ПОВЕРХНІ»
Перед виконанням лабораторної роботи необхідно передусім засвоїти основні закономірності адсорбції на рідкій поверхні: поняття поверхнево-активних (ПАР) та поверхнево-інактивних (ПІАР) речовин, термодинаміку адсорбції (рівняння Гіббса), методику розрахунку величин надлишкової адсорбції на рідкій поверхні та принцип побудови ізотерми адсорбції. Необхідно ознайомитись з методами визначення поверхневого натягу рідин і розмірів молекул ПАР (довжини та площі, що займає одна молекула на рідкій поверхні).
Стислі теоретичні відомості Шар рідини, що прилягає до її поверхні та має товщину, сумірну з відстанню, на якій діють міжмолекулярні сили, називається поверхневим шаром. Молекули рідини в поверхневому шарі перебувають під дією сил притягання сусідніх молекул. Рівнодіюча цих сил притягання спрямована углиб рідини. Тому переміщення молекул з глибини рідини в поверхневий шар вимагає виконання системою роботи проти сил притягання. Робота, яку необхідно виконати для збільшення площі поверхні рідини на одиницю, називається поверхневим натягом Робота утворення нової поверхні, яку система виконує внаслідок перебігу ізотермічного оборотного процесу (максимальна робота), чисельно дорівнює зменшенню енергії Гіббса (ізобарно-ізотермічного потенціалу) системи:
а для одиниці площі поверхні
Таким чином, поверхневий натяг дорівнює надлишку енергії Гіббса, що припадає на одиницю площі поверхні. Надлишок поверхневої енергії гетерогенної системи з міжфазною поверхнею поділу площею
Самочинне прагнення до зменшення поверхневої енергії системи може бути реалізоване або шляхом зменшення міжфазної поверхні (наприклад, при коагуляції), або за рахунок зменшення поверхневого натягу розчину. Речовини, які, концентруючись на поверхні поділу фаз, здатні зменшувати її поверхневий натяг, називаються поверхнево-активними речовинами (ПАР). Зв’язок між адсорбційними та енергетичними характеристиками поверхневого шару встановлює рівняння Гіббса
де Г – надлишкова адсорбція (поверхневий надлишок) розчиненої речовини (моль/м2), тобто надлишкова концентрація розчиненої речовини в поверхневому шарі розчину порівняно з його об’ємною концентрацією с; s – поверхневий натяг розчину, Дж/м2; R – універсальна газова стала; T – температура, К. Величина
Існують речовини, зі збільшенням концентрації яких у розчині поверхневий натяг збільшується (рис. 4). В цьому випадку До поверхнево-активних речовин належать органічні молекули, які складаються з неполярного вуглеводневого радикалу та полярної гідрофільної функціональної групи (–OH, –COOH, –SO3H та ін.). Двоїстий характер дифільних молекул проявляється при їх адсорбції на межі поділу фаз (рис. 6), коли вони орієнтуються в адсорбційному шарі полярною групою в напрямку полярної фази (наприклад, води), а неполярною ‑ в напрямку неполярної фази (наприклад, повітря). Поверхнево-інактивними речовинами є сполуки, що добре сольватуються розчинником (сильні та слабкі електроліти, сахароза, уротропін тощо).
У гомологічному ряду ПАР зі збільшенням довжини вуглеводневого радикала збільшуються гідрофобні властивості речовини. Це призводить до зменшення її розчинності у воді і підвищення здатності до адсорбції. Встановлено, що в розведених розчинах карбонових кислот або спиртів при збільшенні вуглеводневого ланцюга на одну метиленову групу Зміна поверхневого натягу
де A і B – емпіричні константи. Для розчинів ПАР Диференціювання рівняння (2.2) по концентрації приводить до виразу
підстановка якого в рівняння Гіббса (2.1) дає
При високих концентраціях розчину
де Г¥ – надлишкова адсорбція при максимальному заповненні поверхні (гранична надлишкова адсорбція). Звідси константа В рівняння Шишковського дорівнює
і відповідно
Рівняння (2.4) за виглядом нагадує рівняння Ленгмюра (1.2). Величина поверхневого надлишку Г практично співпадає з абсолютною кількістю адсорбованої речовини a у поверхневому шарі, тому що концентрація адсорбату в розведеному розчині дуже мала у порівнянні з концентрацією в адсорбційному шарі. Константа A в рівняннях Шишковського (2.2) та (2.4) має такий самий зміст, що й константа K в рівнянні Ленгмюра (1.2), і є константою рівноваги процесу адсорбції. Використовуючи рівняння Ленгмюра, можна визначити граничне (максимальне) значення адсорбції З теорії Ленгмюра випливає, що при досягненні граничної адсорбції на поверхні розчину утворюється щільний мономолекулярний шар з молекул ПАР (рис. 7). Це дозволяє розрахувати розміри молекул ПАР за величиною
довжина молекули l в м (товщина адсорбційного шару) обчислюється за формулою:
де V0 – об’єм однієї молекули ПАР; M та r – молярна маса (кг/кмоль) та густина ПАР (кг/м3); NА – число Авогадро (6,023·1026 кмоль–1).
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 294; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.007 с.) |

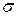 . Поверхневий натягможна розглядати також як силу, що діє на одиницю довжини контуру, який обмежує поверхню та обумовлює її скорочення. Відповідно до наведених визначень поверхневий натяг має розмірність Дж/м2 або Н/м.
. Поверхневий натягможна розглядати також як силу, що діє на одиницю довжини контуру, який обмежує поверхню та обумовлює її скорочення. Відповідно до наведених визначень поверхневий натяг має розмірність Дж/м2 або Н/м. ,
,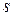 вона складає
вона складає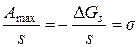 .
.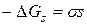 .
.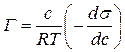 ,
,
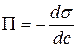 називається поверхневою активністю розчиненої речовини та характеризує її здатність до адсорбції. Якщо зі збільшенням концентрації розчиненої речовини у розчині поверхневий натяг зменшується, тобто
називається поверхневою активністю розчиненої речовини та характеризує її здатність до адсорбції. Якщо зі збільшенням концентрації розчиненої речовини у розчині поверхневий натяг зменшується, тобто 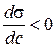 (рис. 4), згідно з рівнянням (2.1) Г > 0 (рис. 5), адсорбція позитивна і ПАР накопичується в поверхневому шарі розчину.
(рис. 4), згідно з рівнянням (2.1) Г > 0 (рис. 5), адсорбція позитивна і ПАР накопичується в поверхневому шарі розчину.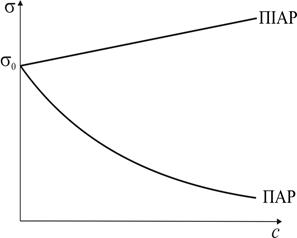
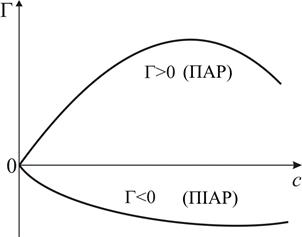
 , Г < 0 (рис. 5), а адсорбція є негативною, тобто концентрація речовини в поверхневому шарі менша, ніж в об’ємі розчину. Такі речовини називаються поверхнево-інактивними (ПІАР).
, Г < 0 (рис. 5), а адсорбція є негативною, тобто концентрація речовини в поверхневому шарі менша, ніж в об’ємі розчину. Такі речовини називаються поверхнево-інактивними (ПІАР).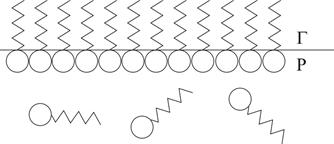
 ,
,
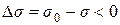 .
.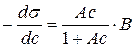 ,
, .
.
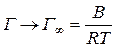 ,
,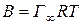
 .
.
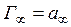 на межі поділу фаз газ/розчин. Розрахунок ізотерми повної адсорбції a = f (c), яку зображено на рис. 1, можна провести також за допомогою рівняння Ленгмюра.
на межі поділу фаз газ/розчин. Розрахунок ізотерми повної адсорбції a = f (c), яку зображено на рис. 1, можна провести також за допомогою рівняння Ленгмюра.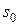 (м2), яку займає одна молекула в адсорбційному шарі, визначається за рівнянням:
(м2), яку займає одна молекула в адсорбційному шарі, визначається за рівнянням: ,
,
 ,
,



