
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота № 6 «одержання та коагуляцiя золів»Содержание книги
Поиск на нашем сайте
Перш ніж приступати до виконання лабораторної роботи, потрібно ознайомитись з методами одержання, стійкістю та властивостями золів, зрозуміти принципи утворення колоїдних міцел, вміти писати їхні формули та визначати складові частини: ядро, потенцiалвизначаючi iони, протиiони, частинка, адсорбцiйний та дифузний шари iонiв, мiцела. Слiд також ознайомитися з правилами коагуляцiї золів електролiтами, факторами стiйкості та методами руйнування колоїдних систем, залежнiстю порога коагуляцiї вiд природи та концентрацiї електролiта, що спричиняє коагуляцію. Стислі теоретичні відомості Основними ознаками колоїдного стану твердої речовини у системі є гетерогенність та дисперсність системи. Подрібнена речовина утворює дисперсну фазу, а безперервне середовище, в якому вона розподілена, називається дисперсійним середовищем. Частинки дисперсної фази є не окремими молекулами, а агрегатами молекул. Розміри частинок дисперсної фази колоїдної системи суттєво більші за розміри молекул та іонів в істинних розчинах. Дисперснi ультрамiкрогетерогеннi системи з розмiрами часток дисперсної фази Колоїдні розчини можуть бути отримані шляхом диспергування або внаслідок процесів фізичної та хімічної конденсації. Фізична конденсація частинок дисперсної фази досягається утворенням її пересичених розчинів у відповідному дисперсійному середовищі. При хімічній конденсації частинки дисперсної фази з’являються у системі внаслідок перебігу в ній хімічної реакції: іонного обміну, гідролізу або окисно-відновного процесу за умови, що в результаті такої реакції утворюється малорозчинна сполука – ядро майбутньої міцели. Для приготування колоїдного розчину шляхом хімічної конденсації необхідно проводити реакцію при низьких концентраціях реагентів (10–5 – 10–3 моль/дм3) для утворення наночасток (10–9 – 10–7 м), використовуючи при цьому значний надлишок одного з реагентів для того, щоб на поверхні кристалу (ядра) утворився подвійний електричний шар – основний чинник агрегативної стійкості. Як приклад, розглянемо механізм утворення міцели колоїдного розчину хлориду срібла за реакцією AgNO3 + KCl = AgCl¯ + KNO3 при надлишку KCl та її будову. Якщо проводити цю реакцію при еквімолярних співвідношеннях речовин, то відбудеться осадження AgCl, але колоїдна система при цьому не утвориться. Якщо ж до розведеного розчину AgNO3 додати надлишок KCl, то у системі з’явиться велика кількість центрів кристалізації – ядер AgCl. Ядро кожної частинки цього золю складається з великої кількості (m) молекул AgCl. За правилом Панета-Фаянса на поверхні ядра з розчину завжди адсорбуються однойменні іони, щоб добудувати кристалічну решітку ядра міцели. Оскільки в розчині у надлишку KCl, на поверхні ядра AgCl накопичується деяка кількість (n) іонів Cl–, які будуть в цьому випадку потенціалвизначаючими іонами (ПВІ). При цьому поверхня ядра набуває негативного заряду. До негативно зарядженої поверхні під дією електростатичних сил притягуються позитивно заряджені протиіони К+ також у кількості (n). Частина цих протиіонів (n – х) буде розміщена ближче до частинки в адсорбційному шарі, а частина (х) – далі від ядра, в об’ємі розчину. Таким чином, ядро, ПВІ та частина протиіонів, що розміщені у нерухомому відносно ядра шарі, складають частинку (гранулу) міцели (рис. 21). Частинка золю має заряд, проте міцела в цілому завжди є електронейтральною. Міцели колоїдних розчинів наводять у вигляді специфічної формули. Починають запис формули з утвореного ядра міцели, далі записують потенціалвизначаючі іони (ПВІ), після них зазначають протиіони. Особливістю такого запису є те, що в ньому зображують структуру утвореної міцели, розподіляючи протиіони між адсорбційним та дифузним шарами, що дає можливість показати заряджену частинку міцели (гранулу), відокремлюючи її фігурними дужками.
Рис. 21. Формула міцели AgCl та схема її будови Золі можуть існувати і при цьому бути стійкими у разі, коли виконуватимуться три умови: малий розмір частинок (запобігає осіданню); наявність електричного заряду (запобігає коагуляції); сольватація частинок (запобігає їх подальшому росту). Особливе значення мають способи одержання колоїдних систем, засновані на пептизації. При пептизації високодисперсні частинки осаду, що утворилися в результаті хімічної реакції, диспергуються до колоїдного стану. Для цього їх обробляють такими реагентами, які сприяють утворенню на поверхні частинок подвійного електричного шару (ПЕШ), внаслідок чого частинки набувають заряду і диспергуються у дисперсійному середовищі. Витрати енергії на таке утворення золю значно менші, ніж при диспергуванні твердого тіла. За механізмом утворення ПЕШ пептизацію поділяють на адсорбційну та диссолюційну. Чим більш ліофільним є осад і чим менше часу пройшло з моменту коагуляції, тим ефективнішою є пептизація. Стійкість дисперсійної системи характеризується здатністю зберігати в часі свої основні параметри: дисперсність та рівноважний розподіл дисперсної фази в дисперсійному середовищі. Термодинамічно стійкими є лише ліофільні системи, які здатні утворюватись в результаті самочинного диспергування (D G < 0). Лiофобнi системи мають бiльший запас вiльної поверхневої енергiї, тому вони термодинамiчно нестiйкi і не здатні диспергуватись самочинно (D G > 0). Такі системи схильні до агрегації частинок, що призводить до зменшення міжфазної поверхнi і, як наслідок, до зменшення вiльної поверхневої енергiї. Укрупнення частинок дисперсної фази шляхом їх злипання називається коагуляцією. Таким чином, у ліофобних системах процес злипання часток (коагуляція) є термодинамічно вигідним і самочинним. Коагуляція призводить до порушення агрегативної та седиментаційної стійкості, наслідком чого є випадання осаду. Коагуляцію можна спричинити зміною температури, рН розчину, введенням у систему електролітів, перемішуванням, дією сонячного світла та ін. Найефективнішим методом коагуляції є введення в систему електролітів. Будь-який електроліт при певній концентрації може спричинити коагуляцію. Важливо лише те, щоб концентрація електроліту в системі була достатньо великою для стиснення подвійного електричного шару та зниження енергетичного бар’єру, який запобігає злипанню частинок при їх наближенні. Поріг коагуляції γ – це найменша концентрація електроліту, яка необхідна для початку коагуляція золю. Він вимірюється в моль-екв/м3. Гарді встановив, що коагуляцію золю викликають лише іони, протилежні за знаком до заряду колоїдної частинки. Таким чином, коагуляція золів з негативно зарядженими частинками відбувається лише під впливом катіонів, а коагуляція золів з позитивно зарядженими частинками – лише під впливом аніонів. Відповідно до правила Шульце-Гарді (правило валентності – значності) коагулююча сила іона тим більша, чим більша його валентність. При цьому коагулююча сила іона зростає значно швидше, ніж його валентність. Це емпіричне правило підтверджується теорією ДЛФО, згідно з якою поріг коагуляції обернено пропорційний шостому степеню валентності коагулюючих іонів: Метою роботи є одержаннязолів різними методами, встановлення заряду колоїдних частинок, визначення порогу коагуляції золів. Робота 6.1.Приготування золів Хід виконання роботи 1. Відповідно до номеру бригади згідно із завданнями табл. 6.1 написати у протокол роботи наведені нижче прописи приготування вказаних золів. Після кожного пропису залишити вільними чотири рядки для запису спостережень, рівнянь реакцій та формул міцел золів. 2. Точно за прописами провести досліди. Для кожного з отриманих золів записати спостереження і рівняння реакції, за якою він був отриманий. Обов’язково зазначити, який із реагентів був взятий у надлишку, і навести формулу утвореної міцели. При визначенні надлишку Таблиця 6.1. Завдання до виконання роботи
вважати, що в 1 см3 розчинів міститься приблизно 40 крапель. 1. Фiзична конденсацiя (замiна розчинника) А. Золь канiфолi у водi. До 50 см3 води додають при безперервному перемiшуваннi 10–15 крапель 10 % – го спиртового розчину канiфолi (з крапельницi). При цьому утворюється «бiлий» золь канiфолi з негативно зарядженими колоїдними частками. Золь опалесцiює.
Б. Золь сiрки у водi. До 50 см3 води додають пiпеткою при перемiшуваннi 1 см3 насиченого розчину сiрки в ацетонi. Утворюється блакитно-бiлий золь опалесцiюючої сiрки у водi з негативно зарядженими колоїдними частинками.
В. Золь парафiну. До 50 см3 води додають пiпеткою при перемiшуваннi 1 см3 насиченого розчину парафiну в етанолi. Утворюється золь парафiну у водi з негативно зарядженими колоїдними частинками, який опалесцiює. Хiмiчна конденсацiя
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.167.229 (0.009 с.) |


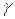 ~
~  . Таким чином, поріг коагуляції тим менший, чим вища валентність коагулюючого іона.
. Таким чином, поріг коагуляції тим менший, чим вища валентність коагулюючого іона.


