
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1: Визначення калориметричної сталої.Содержание книги
Похожие статьи вашей тематики
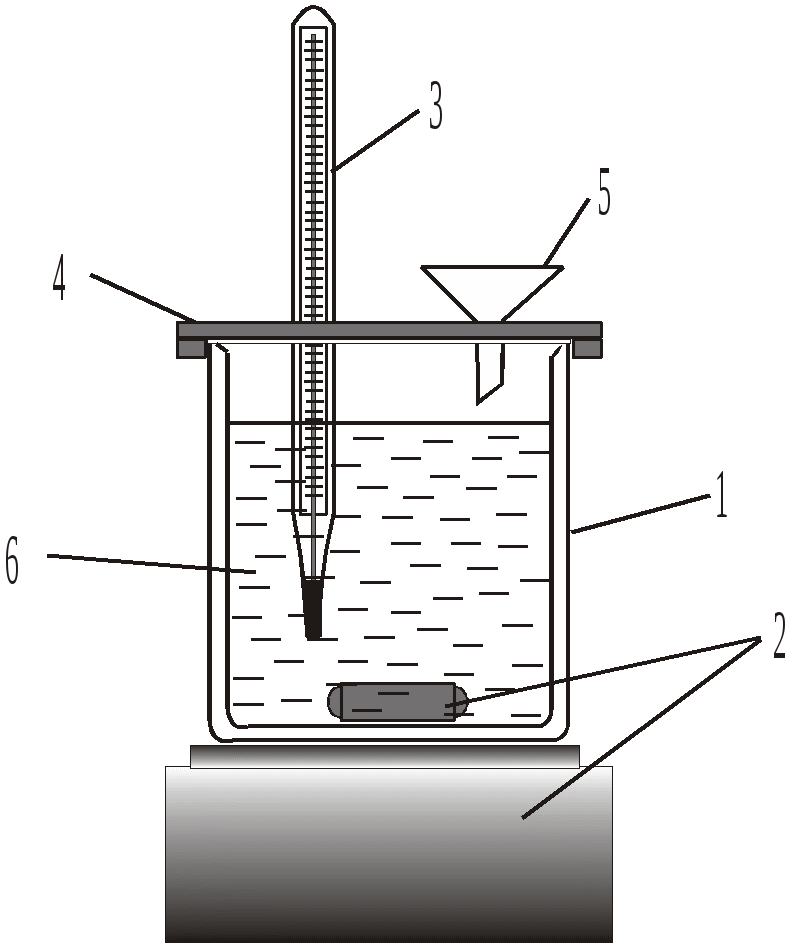
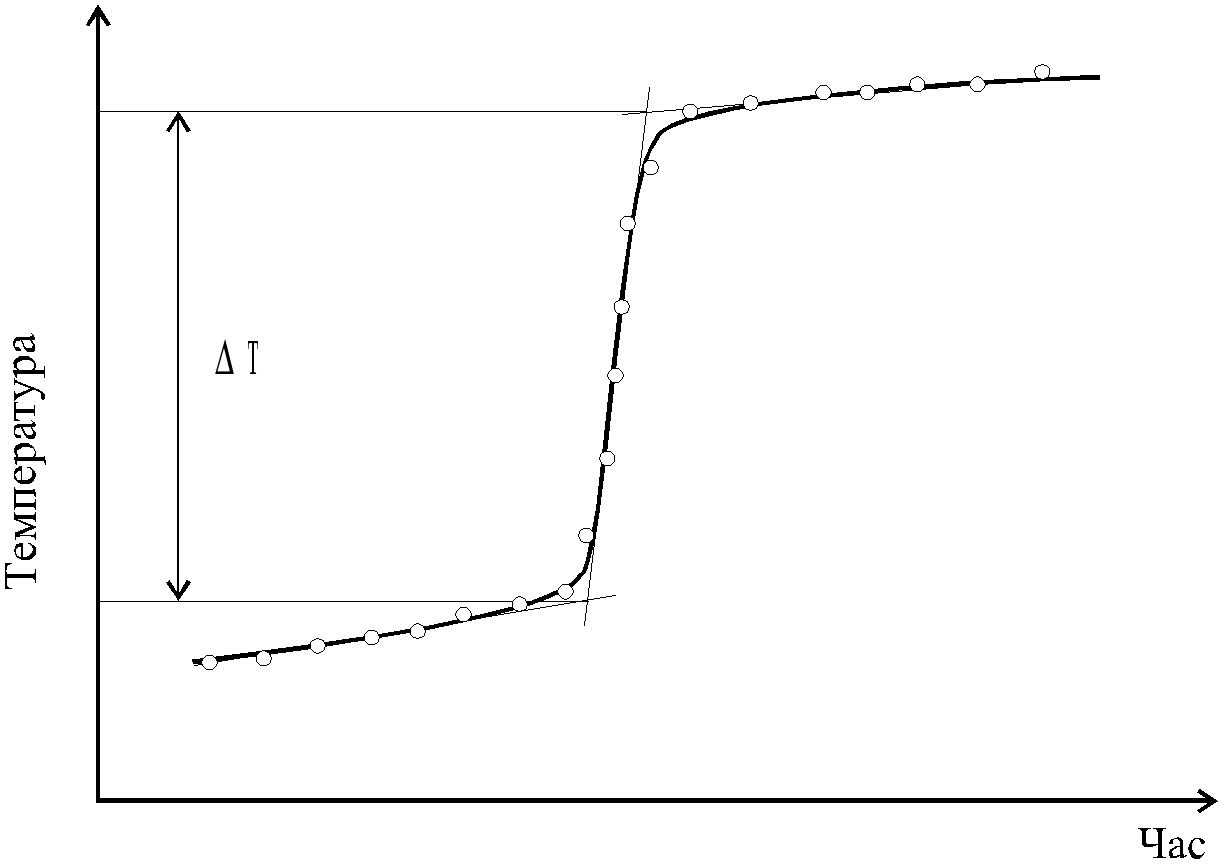
Поиск на нашем сайте Дослідження процесу нейтралізації проводять в установці, зображеній на рис. 1. Сталу калориметричної установки (К), зображеної на рис. 1, можна визначити за відомою теплотою розчинення якої-небудь солі чи лугу, наприклад, за відомою теплотою розчинення натрію гідроксиду – 112,1 кДж/моль. В склянку 1 наливають 500 см3 дистильованої води, включають магнітну мішалку і спостерігають за температурою, значення якої можуть коливатись за рахунок теплообміну з навколишнім середовищем. Відмічають температуру з точністю 0,10 С кожних півхвилини. З точністю 0,01 г на технічних вагах зважують 5 г попередньо висушеного гранульованого гідроксиду натрію. Після стабілізації температури системи, через отвір 5 вносять наважку твердого натрій гідроксиду, продовжуючи відмічати зміну температури з часом. В результаті розчинення натрій гідроксиду температура системи зростатиме (екзотермічний тепловий ефект процесу), а стабілізація температури у часі на деякій позначці свідчитиме про завершення процесу розчинення. Зміну температури у процесі розчинення натрій гідроксиду ілюструє рис. 2.
де Qp – теплота розчинення гідроксиду натрію (112,1 кДж/моль); m – кількість молів лугу.
Враховуючи цей момент, тепловий ефект нейтралізації обчислюють, виходячи із наступної формули: де К – калориметрична стала; m – кількість натрій гідроксиду, взятого для нейтралізації; D Т – сумарний скачок температури за рахунок екзотермічного розчинення та екзотермічного теплового ефекту нейтралізації. Результати досліджень вносять у таблицю 1. Таблиця 1 Результати калориметричних досліджень процесу нейтралізації
Табличне значення Qн, кДж/моль -- 55,9 Висновок: __________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Контрольні питання та практичні завдання 1. Дайте визначення понять система, процес, параметри, функція стану. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Дайте визначення понять теплота утворення, теплота розкладу, теплота згорання, тепловий ефект хімічної реакції. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Сформулюйте закон Гесса і його наслідки. __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. В ізольованій системі протікає реакція спалювання водню з утворенням рідкої води. Чи зміниться внутрішня енергія системи? ______________________________________________________________________________________________________________________________________________________________________________________________________ 5. Як розрахувати зміну внутрішньої енергії та ентальпії системи в термодинамічному процесі? __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 6. Завдання. Обчисліть тепловий ефект реакції спалювання етилену, якщо відомі теплоти утворення: ΔН(С2Н4) = 52кДж/моль; ΔН(О2) = 0кДж/моль; ΔН(СО2) = -394кДж/моль; ΔН(Н2О) = -242кДж/моль. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Тема 1.1.: «Основи хімічної термодинаміки» Лабораторна робота № 2 Дата проведення роботи______________________ «Визначення коефіцієнта розподілу йоду Між бензолом та водою» Мета роботи: 1. Оволодіння уміннями проведення експериментальних досліджень. 2. Експериментальним шляхом навчитися визначати коефіцієнт розподілу йоду між бензолом та водою. Реактиви, посуд і прилади: розчини йоду в бензолі різної концентрації (0,5%; 1%; 1,5%; 2%), дистильована вода, мірний циліндр ємністю 50мл, конічні колби ємністю 100мл – 5 шт., ділильна лійка з пробкою – 5 шт., однопроцентний розчин крохмалю, піпетка, 0,05н розчин тіосульфату натрію. ТЕОРЕТИЧНЕ ПІДГРУНТЯ Прикладом трьохкомпонентної системи є суміш, що складається із двох практично нерозчинених рідин і третьої речовини, що розподіляється між ними. Наприклад, якщо в систему вода – бензол додати йод і перемішати, то йод буде знаходитись і в водному, і в бензольному шарі. Однак концентрація йоду в бензолі буде значно вищою, ніж у воді. Якщо додати ще певну кількість йоду, то концентрація його в кожному шарі зміниться, але відношення концентрацій у кожному шарі збережеться постійним. Німецький фізико-хімік В.Нернст у 1891 році це положення сформулював у вигляді закону:
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 547; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

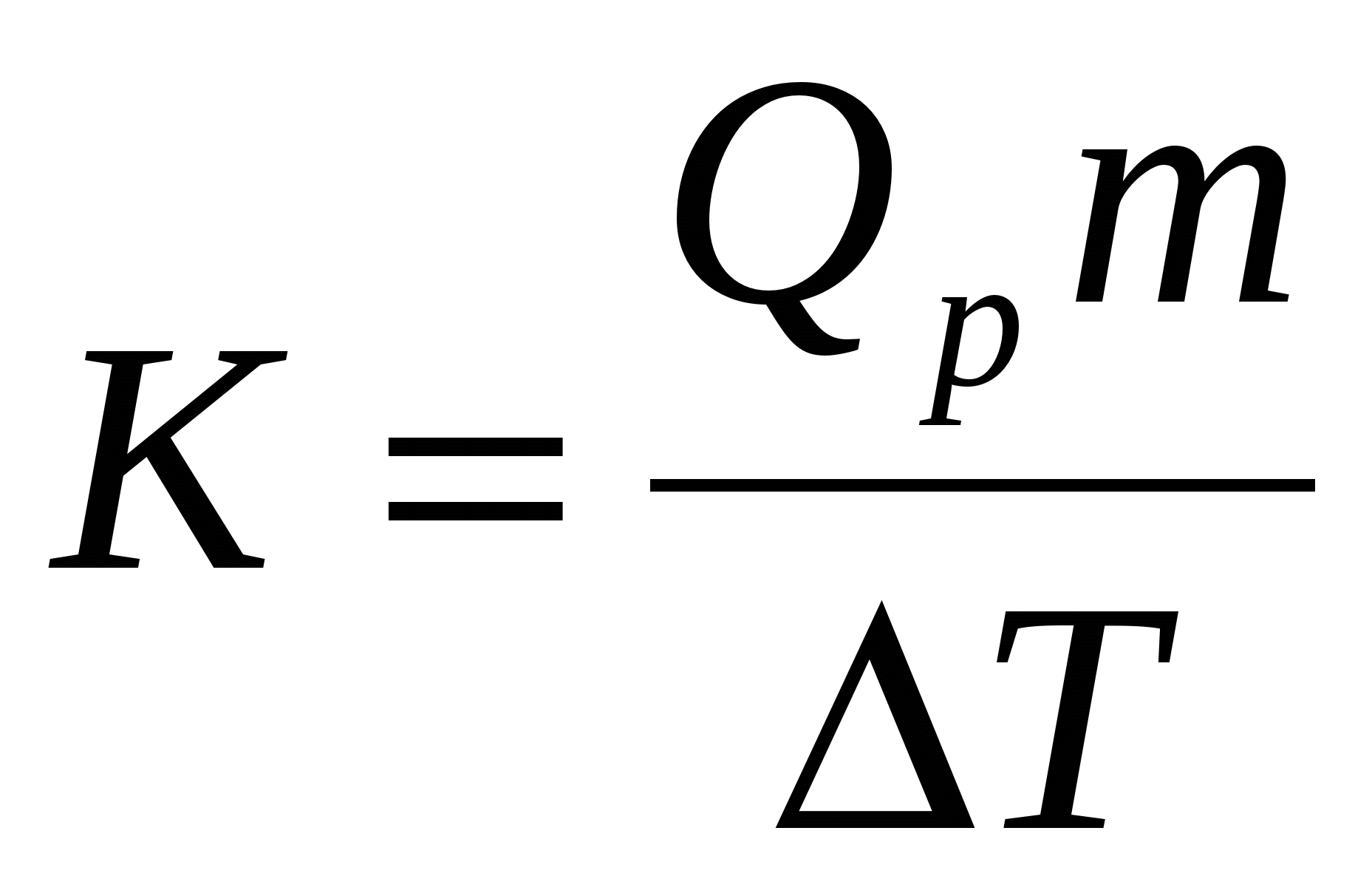 ,
, ,
,


