
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота № 2. Визначення теплового ефекту реакції нейтралізації сильних та слабких кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Мета роботи – визначити значення теплоти нейтралізації сильних та слабких кислот та теплоти дисоціації слабких кислот, які супроводжують реакцію взаємодії кислот та основ. Тепловим ефектом реакції нейтралізації ( Молярною інтегральною теплотою нейтралізації (
де n – кількість моль-еквівалентів кислоти чи лугу, що прореагували. Реакцію нейтралізації сильних кислот сильними основами в іонній формі можна записати таким чином: Na+ + OH-+ H3O+ + Cl- або H3O+ + OH- З цього випливає, що взаємодія сильних кислот з сильними основами супроводжується виділенням однакової кількості теплоти. За табличним даними в цьому випадку Величина теплового ефекту реакцій нейтралізації слабких кислот залежить від сили кислоти. В загальному вигляді реакцію нейтралізації одноосновних слабких кислот, наприклад оцтової, можна представити таким чином: НАс + NaOH = NaАс + Н2O + ΔНнейтр., НАс (1.14). Цей процес складається з реакції дисоціації слабкої кислоти: НАс + Н2O = H3O+ + Ас- + ΔНдис., НАс (1.15) та самої нейтралізації (1.13): H3O+ + OH- = 2Н2O + ΔНнейтр.. Тому тепловий ефект нейтралізації слабкої кислоти (
Хід роботи При підготовці до лабораторної роботи слід прочитати та ретельно законспектувати основні засади калориметрії і правила роботи з калориметричними пристроями (розділи 1.1 – 1.3). Методика проведення експерименту складається з трьох експериментальних та розрахункової частин. 1. Визначають сталу калориметру К´ за розчиненням KCl або К електричним методом (див. розділи 1.2.3, 1.2.5, 1.3.2 та 1.3.3). 2. Експериментально визначають теплоту нейтралізації сильної кислоти. Для чого в калориметричний стакан заливають 300 мл 0,1 М NaOH, поміщають скляну ампулу з 5 – 10 мл 2 М НCl (або будь-яку іншу кислоту чи луг). Вмикають мішалку, фіксують 9 – 10 відліків початкового періоду. На наступному відліку розбивають ампулу, не припиняючи вимірювання температури протягом головного періоду та ще 10 відліків кінцевого періоду. Результати вимірювань заносять в таблицю 1.1, будують графік залежності DТ від t та визначають DТексп. (розділи 1.2.3 – 1.2.5). 3. Експериментально визначають теплоту нейтралізації слабкої кислоти. Для цього в калориметричний стакан заливають 300 мл 0,1 М NaOH, поміщають скляну ампулу з 5 – 10 мл 2 М НАс (або будь-яку іншу слабку кислоту чи луг). Вмикають мішалку, фіксують 9 – 10 відліків початкового періоду. На наступному відліку розбивають ампулу, не припиняючи вимірювання температури протягом головного періоду та ще 10 відліків кінцевого періоду. Результати вимірювань заносять в таблицю 1.1, будують графік залежності DТ від часу і визначають DТексп. 4. Розраховують 5. Обчислюють Контрольні питання та задачі до лабораторної роботи №2 1. Суть калориметричного методу. Етапи калориметричних вимірювань. 2. Що таке стала калориметра? 3. Які способи визначення сталої калориметра? 4. Чим відрізняються К і К´? 5. Що таке тепловий ефект? 6. Що таке теплота нейтралізації? 7. Чому відрізняється теплота нейтралізації слабкої та сильної кислоти чи лугу? 8. * За довідковими даними розрахуйте тепловий ефект реакції нейтралізації при стандартних умовах. Чи відрізняються ΔНнейтр та ΔUнейтр? 9. * Які кислоти та луги можна використовувати для визначення теплоти нейтралізації? 10. * Як визначити тепловий ефект реакції гідроліза ацетат-іона? 11. * Запропонуйте план експерименту для визначення теплового ефекту реакції дисоціації слабкої основи. 12. * Запропонуйте план експерименту для визначення теплового ефекту реакції гідроліза NH4Cl.
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 452; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.227 (0.01 с.) |

 ) називають кількість теплоти, яка виділяється при взаємодії кислоти з основою.
) називають кількість теплоти, яка виділяється при взаємодії кислоти з основою.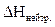 ) називають кількість теплоти, яка виділяється при взаємодії одного молю кислоти з одним молем основи. Тому знаючи
) називають кількість теплоти, яка виділяється при взаємодії одного молю кислоти з одним молем основи. Тому знаючи  можна визначити
можна визначити  ,
, Na+ + Cl- +Н2O (1.12),
Na+ + Cl- +Н2O (1.12), = -54,4·103 Дж/моль. Тобто це екзотермічний процес,
= -54,4·103 Дж/моль. Тобто це екзотермічний процес, 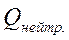 =
=  > 0. При проведенні експерименту одночасно з нейтралізацією має місце процес розведення, але значення теплоти розведення невеликі, тому ними нехтують.
> 0. При проведенні експерименту одночасно з нейтралізацією має місце процес розведення, але значення теплоти розведення невеликі, тому ними нехтують. ) дорівнює сумі теплот дисоціації та нейтралізації:
) дорівнює сумі теплот дисоціації та нейтралізації: (1.16).
(1.16). ,
,  за співвідношенням (1.8) або (1.2) та (1.5), в залежності від того як визначалась стала калориметру.
за співвідношенням (1.8) або (1.2) та (1.5), в залежності від того як визначалась стала калориметру. за співвідношенням (1.16).
за співвідношенням (1.16).


