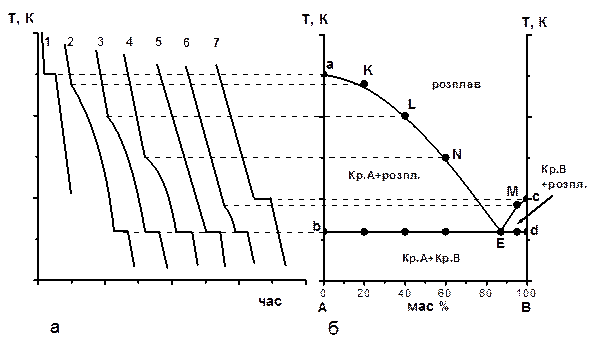Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота № 8. Термічний аналізСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Мета роботи – одержати криві охолодження для нафталіну, дифеніламіну та їх сплавів відомого складу й побудувати діаграму плавкості системи дифеніламін – нафталін. Вивчення багатокомпонентних систем, які утворюють декілька фаз, проводять за допомогою фізико-хімічного аналізу, основу котрого складає вивчення функціональної залежності між фізичними властивостями (електричними, механічними, оптичними та ін.) хімічної рівноважної системи та факторами, що визначають рівновагу. Дослідні залежності зображують у вигляді діаграм стану склад – властивость. Для двокомпонентних систем склад відкладають звичайно на вісі абцис, а властивості – на вісі ординат. Одним з найбільш розповсюджених видів фізико-хімічного аналізу є термічний аналіз, котрий являє собою сукупність експериментальних методів визначення температури, при якій в рівноважній системі змінюється число фаз. На рис. 3.7 подано спосіб побудови діаграми стану (діаграми плавкості). На рис. 3.7а наведені криві охолодження (залежності температура – час), за якими побудована діаграма плавкості (рис. 3.7б) двокомпонентної системи з безмежною розчинністю компонентів у рідкому і взаємною нерозчинністю у твердому станах (системи двох неізоморфних речовин).
Рис. 3.7. Побудова по кривим охолодження діаграми плавкості двокомпонентної системи Якщо чисті компоненти А або В (криві 1 або 7) нагріти до високої температури, а потім охолоджувати їх, то температура буде рівномірно знижуватись, доки розплав не почне кристалізуватися. При кристалізації буде виділятися теплота, і зниження температури на деякий час припиниться, а на кривих охолодження 1 і 7 спостерігається горізонтальний відрізок, який відповідає температурі кристалізації чистих компонентів. Коли весь розплав стає твердим, спостерігається монотонне зменшення температури. За кривими охолодження 1 та 7 наносять дві фігуративні точки на діаграмі плавкості (рис. 3.7б). Для цього продовжують горизонтальні ділянки кривих 1 та 7 (див. пунктирні линії) та наносять точки a (100 % А) та с (100 % В). Якщо система складається з двох компонентів, то на кривій охолодження з’являються нові за характером ділянки. Коли при охолодженні такої системи (криві 2, 3, 4 та 6) буде досягнута температура, при якій розчин стає насиченим відносно одного з компонентів, то цей компонент починає кристалізуватися. При цьому виділяється теплота, котра дещо сповільнює охолодження, тому на кривих в цьому місці спостерігається злам. Далі криві йдуть не горизонтально, а монотонно знижуючись, оскільки по мірі кристалізації одного компонента розплав збагачується другим компонентом, тобто склад рідкої фази змінюється, а це зменшує температуру кристалізації. Нарешті розплав стає насиченим відносно обох компонентів, внаслідок чого при охолодженні А та В кристалізуються одночасно. Склад рідкої фази при цьому не змінюється, і суміш кристалізується, як індивідуальна речовина, а на кривих охолодження 2, 3, 4 та 6 спостерігається горизонтальна ділянка. Після завершення кристалізації всього зразку, температура починає різко зменшуватися. За зламами на кривих 2, 3, 4 та 6 на діаграму плавкості наносять фігуративні точки К, L, N та M. Якщо склад системи такий, що в момент початку затвердіння розплав насичений відносно обох компонентів, то при її охолодженні кристалізуються одночасно А та В, а крива має такий же характер, що й індивідуальна речовина (рис. 3.7а, крива 5). Такий сплав називається евтектичним. Він плавиться або кристалізується при найбільш низький температурі порівняльно з іншими. Твердий евтектичний сплав містить дві твердих фази (кристали А та В). За горізонтальним відрізком кривої 5 на діаграму наносять точку Е. З’єднуючи на діаграмі плавкості (рис. 3.7б) точки а, К, L, N, Е, M та c, одержують лінію ліквідуса, вище якої система знаходиться в рідкому стані. Через мінімум Е проводять горизонтальну пряму лінію bd – солідус, нижче якої система знаходиться в твердому стані. Хід роботи 1. Чисті речовини та їх сплави вміщують в скляні пробірки, закриті корками з термометром. 2. Пробірки вміщують на водяну баню та нагрівають до температури, котра на декілька градусів більше температури повного розплавлення чистих речовин або сплавів. 3. Пробірку з розплавом закріплюють у штативі та охолоджують на повітряній бані, реєструючи температуру розплаву кожні 30 – 60 секунд за вказівкою викладача з точністю до 0,5°С. Результати дослідів заносять до таблиці 3.4. Таблиця 3.4
4. Охолодження проводять до повної кристалізації розплаву (за вказівкою викладача). 5. Будують криві охолодження в координатах температура – час. 6. За кривими охолодження будують діаграму плавкості. Контрольні запитання до лабораторної роботи № 8 1. В чому полягає фізико-хімічний аналіз? 2. В чому полягає термічний аналіз? 3. Криві охолодження, їх характер в залежності від складу сплава. Як побудувати діаграму плавкості за кривими охолодження? 4. Навести діаграми плавкості та побудувати криві охолодження для систем а) ізоморфних речовин; б) неізоморфних з простою евтектикою; в) з двома хімічними сполуками, котрі конгруентно плавляться; г) з двома хімічними сполуками, котрі інконгруентно плавляться. 5. На діаграмах плавкості з п. 4 нанесіть фігуративні точки, які відповідають а) рівновазі двох твердих фаз; б) рівновазі трьох фаз; в) одній твердій фазі; г) рівновазі двох фаз однакового складу; д) рівновазі трьох фаз. Розрахуйте в цих точках число ступенів свободи. 6. В чому полягає відмінність поняттів «евтектика», «евтектична точка» та «евтектична температура»? Питання до теми «Термодинаміка» 1. Сформулюйте перше начало термодинаміки. 2. Запишіть математичний вираз перше начало термодинаміки для ізотермічного процесу 3. Запишіть математичний вираз першого начала термодинаміки для ізобарного процесу 4. Запишіть математичний вираз першого начала термодинаміки для ізохорного процесу 5. Запишіть математичний вираз першого начала термодинаміки для адіабатного процесу. 6. Які величини математичний у виразі першого начала термодинаміки є функціями стану, а які – функціями процесу? 7. Сформулюйте закон Гесса. 8. Сформулюйте слідства з закону Гесса. 9. Як закон Гесса використовується для розрахунків теплових ефектів? 10. Як обчислити дійсну і середню теплоємність газів, рідин і твердих тіл за будь-якої температури? 11. Як визначити тепловий ефект хімічної реакції на основі теплот утворення або теплот згоряння. 12. Як обчислити кількість теплоти, необхідної для нагрівання одиниці маси речовини від Т1 до Т2? 13. Вивести формули для розрахунку роботи розширення різних процесів. 14. Що таке теплоємність? Види теплоємності. 15. Як залежить теплоємність від температури? 16. Що таке ентальпія? Чи можна визначити абсолютне значення ентальпії речовини? Обґрунтуйте свою відповідь. 17. Як впливає температура на тепловий ефект хімічної реакції? 18. Застосовується чи ні закон Гесса до процесів фазових і агрегатних перетворень, процесів розчинення і розведення? 19. Як визначити абсолютну ентропію речовини? Які дані для цього потрібні? 20. Як обчислити зміну ентропії в різних процесах зміни параметрів стану, агрегатних і фазових перетвореннях, утворенні розчинів, змішуванні газів та хімічних реакціях? Питання до теми «Хімічна рівновага. Рівноважні процеси» 1. Які існують критерії для визначення спрямованості довільного перебігу та рівноваги фізико-хімічних процесів? 2. Як визначити зміну енергії Гіббса ΔG хімічної реакції за будь-якої температури її перебігу? 3. Дати оцінку впливу температури і тиску на зміну енергії Гіббса і Гельмгольца речовини в газоподібному, рідкому і твердому стані. 4. Що таке хімічний потенціал? Від яких чинників і як він залежить? Напишіть належні рівняння. 5. Що таке хімічна рівновага? Що таке константа рівноваги? Сформулюйте закон діючих мас. 6. Що є критерієм напрямку хімічної реакції? Яка термодинамічна умова досягнення рівноважного стану? 7. Запишіть і проаналізуйте рівняння ізотерми хімічної реакції Вант-Гоффа. 8. Поясніть і проаналізуйте рівняння ізотерми хімічної рівноваги і рівноважного виходу продукту реакції з використанням таблиць стандартних термодинамічних величин. 9. Поясніть, як і чому впливає підвищення температури на величину константи рівноваги? (Аналіз рівняння ізобари-ізохори Вант-Гоффа). 10. Чому при значному підвищенні тиску Кр змінює своє значення? 11. Які чинники і як впливають на рівноважний вихід продукту реакції? 12. Які чинники і як впливають на зсув хімічної рівноваги? Питання до теми «Фазові рівноваги» 1. Що таке фаза, компонент та ступінь свободи? 2. Яка загальна термодинамічна умова фазової рівноваги? 3. Правило фаз Гіббса та його застосування до різних систем. 4. Наведіть та проаналізуйте рівняння Клапейрона – Клаузіуса. 5. Що таке потрійна точка на діаграмі стану однокомпонентної системи? 6. Що називають насиченою парою? 7. Наведіть та проаналізуйте типову діаграму стану однокомпонентної системи. 8. Як залежить тиск насиченої пари над конденсованою фазою від температури? Поясніть цю залежність за допомогою рівняння Клапейрона – Клаузіуса. 9. Поясніть за допомогою рівняння Клапейрона – Клаузіуса, як залежить температура плавлення від тиску. 10. Якими точками починається та скінчується крива залежності тиску насиченої пари рідини від температури? 11. Яким має бути тиск насиченої пари рідини при її кипінні? 12. * Поясніть, чому при нагріванні на повітрі лід плавиться, а йод сублімує? 13. Що називається розчином? 14. Які способи вираження концентрації розчинів Вам відомі? Який зв’язок між різними одиницями концентрації? 15. Сформулюйте закон Рауля та наслідки з нього. 16. Схематично накресліть на діаграмі стану чистого розчинника криві залежності насиченої пари розчинів нелеткої речовини різних концентрацій від температури. Чи можливо на цих діаграмах показати, як змінюються температури кипіння та замерзання розчинів в залежності від їх концентрації? 17. Способи зображення діаграм стану дво- та трикомпонентних систем. СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ 1. Стромберг А.Г., Сёмченко Д.П. Физическая химия – М.: Высшая школа, 1988. – 496 с. 2. Физическая химия: Учебное пособие для вузов / Под ред. К.С. Краснова – М.: Высшая школа, 1982. – 687 с. 3. Кондратьев С.Н. Кратний курс физической химии – М.: Высшая школа, 1978. – 268 с. 4. Эткинс П. Физическая химия. – М.: Мир, 1980. – Т. 1. – 580 с. 5. Практикум по физической химии/Под ред. В.В. Буданова и Н.К. Воробьева. – М.: Химия, 1986. – 352 с. 6. Практикум по физической химии/Под ред. И.В. Кудряшова. – М.: Высшая школа, 1974. – 396 с. 7. Практикум по физической химии/Под ред. С.В. Горбачева. – М.: Высшая школа, 1974. – 510 с. 8. Голиков Г.А. Руководство по физической химии. – М.: Высшая школа, 1988. – 382 с. 9. Кудряшов И.В., Каретников Г.С. Сборник примеров й задач по физической химии. – М.: Высш. школа, 1991. – 526 с. 10. Киселёва Е.В., Каретникова Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – М., Высш. школа,1983. – 456 с. 11. Сборник вопросов и задач по физической химии для самоконтроля / под ред. Белевского С.Ф. – М.: Высшая школа, 1979 – 119 с. 12. Краткий справочник физико-химических величин / Под ред. Мищенко К.С., Равделя А.А. – Л.: Химия, 1983. – 231 с. 13. Методичні вказівки для виконання індивидуальних завдань з фізичної хімії (довідкові дані). Частина І. / Укл.: О.В. Кравцов, Д.А. Сухомлин. – Дніпропетровськ: УДХТУ, 2007. – 56 с. (МВ № 1395) 14. Методичні вказівки для математичної та статистичної обробки експериментальних даних при вивченні курсу «Фізична хімія» студентами-технологами денної форми навчання / Укл. Ф.Й. Данилов, Д.В. Гіренко, О.А. Бєляновська, Д.А. Головко. – Дніпропетровськ: УДХТУ, 2006. – 30 с. (МВ № 1321)
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.85.96 (0.009 с.) |