
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна будова деяких напівсинтетичних пеніцилінівСодержание книги
Поиск на нашем сайте
Промислове отримання 6-АПК шляхом хімічного гідролізу бензилпеніциліну пов’язане зі значними труднощами у зв’язку з нестійкістю b-лактамного кільця молекули пеніциліну. Так, у разі лужного гідролізу бензилпеніциліну вихід 6-АПК становить лише 1%. Продуктивність цього процесу можна підвищити використовуючи для гідролізу імобілізовані бактеріальні клітини, що містять пеніцилінамідазу. З другої половини 70-х років ХХ ст. вся 6-АПК, що випускається в Росії, та значна частина 6-АПК, яку отримують в Італії, виготовляється за допомогою імобілізованих ферментів. На італійських фірмах використовують фермент, імобілізований шляхом включення клітин E.coli у волокна триацетатцелюлози, а на російських підприємствах застосовують бактеріальні клітини, імобілізовані у поліакриламідному гелі. Використання таких технологій забезпечує вихід кінцевої продукції на рівні 80 – 85%. За даними японських вчених, час напівінактивації пеніцилінамідази, що міститься в імоблізованих в поліакриламідному гелі бактеріальних клітинах, становить 42 доби при 30°С або 17 діб при 40°С. 6-АПК підлягає хімічному ацилюванню в результаті якого утворюються напівсинтетичні пеніциліни. Отримано близько 50 тис. сполук, з них 35 використовують у практиці. Всі відомі напівсинтетичні пеніциліни, як і бензилпеніцилін, пригнічують синтез клітинної стінки бактерій. Основним завданням при синтезі нових пеніцилінів є отримання препаратів, які стійкі до дії b-лактамаз, та препаратів з пролонгованою дією.
Цефалоспорин Цефалоспоринові антибіотики використовуються у клінічній практиці з початку 60-х років ХХ ст. Синтезовано більше 50 представників цієї групи антибіотиків. Ядром молекули цефалоспоринів є 7-аміноцефалоспоринова кислота. За хімічною будовою належить до b-лактамних антибіотиків, близьких до пеніциліну, в біосинтезі основного ядра (цефемового) приймають участь дві амінокислоти L-цистеїн, L-валін.
Цефалоспорин С
Цефалоспорини – антибіотики, що утворюються грибами роду Cephalosporium acremonium (Acremonium chrysogenum). Вперше цефалоспорин було виділено у 1948 році Джузеппе Бротцу. В культуральній рідині Cephalosporium acremonium він виявив три варіанти цефалоспоринів: P, N та C. Цефалоспорин С головний антибіотик, на основі якого було створено багаточисельні напівсинтетичні препарати з цінними властивостями. За біологічною активністю цефалоспорини відрізняються від пеніцилінів. Цефалоспорини пригнічують розвиток грампозитивних і грамнегативних бактерій, але їхня антибіотична активність нижча ніж у пеніцилінів. Продуцент – Cephalosporium acremonium (Acremonium chrysogenum). Механізм біосинтезу цефалоспорину. Первинні стадії біосинтезу пеніциліну і цефалоспорину ідентичні. До ізопеніциліну N. Лише після цього шляхи розходяться. Пеціцилін N перетворюється в деацетоксицефалоспорин. Далі за дії ферменту гідроксилази утворюється деацетилцефалоспорин. Який ферментом ацетил-Ко-трансферазою перетворюється у цефалоспорин С.
Кетоглутарат Ацетил-КоА
Гомоцитрат
a-Кетоадіпінова кислота
L-a-ААК-L-цистеїн
Моноциклічний b- лактам
Пеніцилін N
Цефалоспорин С Напівсинтетичні цефалоспорини Вихідною речовиною для отримання напівсинтетичних цефалоспоринів є 7-аміноцефалоспоранова кислота, яку отримують в результаті відщеплення від молекули цефалоспорину аміноадипінової кислоти під дією фермента ацилази.
7-аміноцефалоспоранова кислота
Модифікування цефалоспорину може відбуватися шляхом приєднання двох радикалів.
Таблиця8.3
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.175.83 (0.007 с.) |

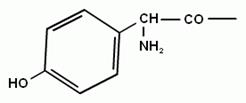
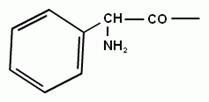

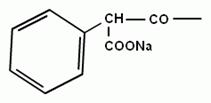
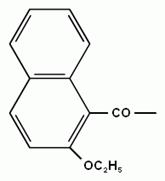

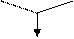


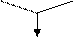 L-a-аміноадіпінова кислота (L-a-ААК) L-цистеїн
L-a-аміноадіпінова кислота (L-a-ААК) L-цистеїн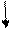
 L-a-ААК- L-цистеїн-D-валін (трипептид)
L-a-ААК- L-цистеїн-D-валін (трипептид)
 Ізопеніцилін N
Ізопеніцилін N
 Деацетоксицефалоспорин
Деацетоксицефалоспорин Деацитилцефалоспорин
Деацитилцефалоспорин



