
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Радіальне рівняння Шредінгера.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Шредінгер отримав у1926 р. рівняння для визначення хвильової функції. Воно дозволяє знайти хвильові функції частинок, які рухаються в різних силових полях. Рівняння виглядає так:
оператор Лапласа, результат дії якого на деяку функцію є сумою других частинних похідних за координатами:
Рівняння Шредінгера є основним рівнянням нерелятивістської квантової механіки. Воно не може бути доведене з інших співвідношень. Його варто розглядати як вихідне основне припущення, справедливість якого доводиться тим, що всі наслідки, які випливають із нього, точно узгоджуються з дослідними фактами. Шредінгер установив своє рівняння, виходячи з оптико-механічної аналогії. Ця аналогія полягає в подібності рівнянь, які описують хід світлових променів, з рівняннями, що визначають траєкторії частинок у класичній механіці.
часто пишуть у вигляді
22. Атом водню. Класиф станів електрону в атомі А́том во́дню — найпростіший із атомів хімічних елементів.Він складається з позитивно зарядженого ядра, яке для основного ізотопа є просто протоном, і одного електрона.Квантовомеханічна задача про дозволені енергетичні стани атома водню розв'язується точно. Зважаючи на цю обставину, хвильові функції, отримані як власні функції цієї задачі, є базовими для розгляду решти елементів періодичної таблиці. До складу атома водню входить ядро з масою M і зарядом +e та електрон із зарядом -e. Взаємодія між ними — кулонівське притягання. Гамільтоніан атома водню має вигляд [1]
де Власні функції гамільтоніана мають вигляд:
Функції характеризуються трьома цілими квантовими числами n = 1,2,3… — основне квантове число. l = 0..n-1 — орбітальне квантове число. m = -l..l — магнітне квантове число. Крім того, електронні хвильові функції характеризуються ще одним квантовим числом — спіном, який з'являється при врахуванні релятивістських ефектів. Спінове квантове число приймає значення
де Z = 1 — зарядове число для ядра атома водню.Енергія власних станів атома водню приблизно дорівнює
де А́том (от др.-греч. неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств[1]. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента. Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы. При описі електронів в атомі в рамках квантової механіки, зазвичай розглядають розподіл ймовірності в 3n-мірному просторі для системи n електронів.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.105.149 (0.007 с.) |

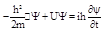 (1).Тут m – маса частинки; i – уявна одиниця; U – потенціальна енергія частинки; D –
(1).Тут m – маса частинки; i – уявна одиниця; U – потенціальна енергія частинки; D –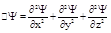 .Рівняння (1) називають загальним рівняннямШредінгера. З рівняння (1) випливає, що вигляд хвильової функції визначається потенціальною енергією U, тобто в остаточному підсумку характером сил, що діють на частинку.
.Рівняння (1) називають загальним рівняннямШредінгера. З рівняння (1) випливає, що вигляд хвильової функції визначається потенціальною енергією U, тобто в остаточному підсумку характером сил, що діють на частинку. (2) Рівняння (2) називається рівнянням Шредінгера для стаціонарних станів(стаціонарне рівняння Шредінгера). Це рівняння
(2) Рівняння (2) називається рівнянням Шредінгера для стаціонарних станів(стаціонарне рівняння Шредінгера). Це рівняння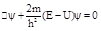 .
. ,
, — радіус-вектор ядра, а
— радіус-вектор ядра, а  — радіус-вектор електрона.
— радіус-вектор електрона.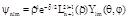 ,де
,де  ,
, 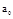 — радіус Бора,
— радіус Бора,  — поліноми Лагера,
— поліноми Лагера, 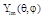 — сферичні гармоніки.
— сферичні гармоніки.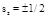 .В основному стані хвильова функція атома водню має вигляд:
.В основному стані хвильова функція атома водню має вигляд: ,
, ,
,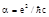 — універсальна стала, яка отримала назву сталої тонкої структури
— універсальна стала, яка отримала назву сталої тонкої структури


