
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теорія Ейнштейна-СмолуховськогоСодержание книги
Поиск на нашем сайте
Це – рівняння Ейнштейна-Смолуховського. Власне, у такому вигляді його отримав Ейнштейн. Результат Смолуховського відрізнявся лише чисельним множником. Подивимося на отриманий результат. Температуру та коефіцієнт внутрішнього тертя ми знаємо. Розміри частинок можна виміряти. Визначити Сталу Больцмана, а через неї і число Авогадро.
Елементи теорії нерівноважних систем Нерівноважний стан, в термодинаміці стан системи, виведеної з рівноваги термодинамічного; в статистичній фізиці — із стану статистичної рівноваги. У системі, що знаходиться в Н. с., відбуваються необоротні процеси, які прагнуть повернути систему в Стан термодинамічної (або статистичного) рівноваги, якщо немає чинників, що перешкоджають цьому, — відведення (або підвода) енергії або речовини з системи. Інакше можливо стаціонарне Н. с. (що не змінюється з часом). Н. с. вивчаються термодинамікою нерівноважних процесів і статистичною теорією нерівноважних процесів. Закон збереження маси в Т. н. п. Для багатокомпонентної системи швидкість зміни маси k- й компоненти в елементарному об'ємі дорівнює потоку маси в цей об'єм r до u до, де r до — щільність, а u до — швидкість компоненти. Закон збереження імпульсу в Т. н. п. Зміна імпульсу елементарного об'єму може відбуватися за рахунок сил, викликаної градієнтом внутрішньої напруги в середовищі P а b, і зовнішніх сил F до. Закон збереження імпульсу, застосований до гідродинамічної швидкості, дозволяє отримати основні рівняння гідродинаміки Закон збереження енергії для елементарних об'ємів є перший початок термодинаміки в Т. н. п. Тут доводиться враховувати, що повна питома енергія складається з питомої кінетичної, питомої потенційної енергії в полі сил F до і питомої внутрішньої енергії u, яка є енергію теплового руху молекул і середню енергію молекулярних взаємодій Рівняння балансу ентропії. В Т. н. п. приймається, що ентропія елементарного об'єму s (локальна ентропія) є такою ж функцією від внутрішньої енергії u, питомого об'єму u = 1/ r і концентрації c до, як і в стані повної рівноваги, і, отже, для неї справедлива звичайна термодинамічна рівність.
Кінетичне рівняння Больцмана Основний метод фізичної кінетики - рішення кінетичного рівняння Больцмана для одночасткової функції розподілу де St - інтегралзіткнень, щовизначаєрізницю числа частинок, щоприходять в елементобсягувнаслідокпрямихзіткнень і відбувають з ньоговнаслідокзворотнихзіткнень. Для одноатомних молекул або для багатоатомних, але без урахуванняїхвнутрішніхступенівсвободи де ω - Вірогідністьзіткнення, пов'язана з диференціальнимефективнимперерізомрозсіяння. де p, p 1 - Імпульси молекул до зіткнення, v, v 1 - Відповідношвидкості, p ', p '1 - Їхімпульсипіслязіткнення, f, f 1 - Функціїрозподілу молекул до зіткнення, f ', f '1 - Їхфункціїрозподілупіслязіткнення. Длягазузіскладних молекул, щоволодіютьвнутрішніми ступенями свободи, їхслідвраховувати у функціїрозподілу. Наприклад, для двоатомних молекул ізвласним моментом обертання M функціїрозподілубудутьзалежатитакожвід M. Зкінетичногорівняннявипливає теорема Больцмана - спаданнязгодом H -Функції Больцмана (середнього логарифма функціїрозподілу) абозростанняентропії, так як вона дорівнює H -Функції Больцмана іззворотним знаком.
Наближення часу релаксації Рівняння Больцмана - складне інтегродиференціальне рівняння в часткових похідних. Окрім того, інтеграл зіткнень залежить від контретної системи, від типу взаємодії між частинками та інших факторів. Знаходження загальних характеристик нерівноважних процесів - непроста справа. Однак, відомо, що в стані термодинамічної рівноваги інтеграл зіткнень дорівнює нулю. Справді, в стані рівноваги в однорідній системі при відсутності зовнішніх полів усі похідні в лівій частині рівняння Больцмана дорівнюють нулю, тож інтеграл зіткнень теж повинен дорівнювати нулю. При малих відхиленнях від рівноваги функцію розподілу можна подати у вигляді
де В цьому випадку можна розкласти інтеграл зіткнень у ряд Тейлора відносно функції
де τ - час релаксації. Таке наближення називається наближенням часу релаксації. Час релаксації, який входить у рівняння Больцмана залежить від швидкості частинок, а отже енергії. Час релаксації можна розрахувати для конкретної системи із конкретним процесами розсіювання частинок. Рівнянн Больцмана в наближенні часу релаксації записується у вигляді
Влатсивості атомних ядер У ядрізосередженамайже вся маса атома (масаелектронів, щовходять в атом, зневажливо мала в порівнянні з масою ядра), вономаєпозитивний заряд, еквівалентнийсумарному заряду вхідних у ньогоелектронів. Заряд ядра будь-якогоелементадорівнюєйого порядковому номеру в періодичнійсистеміелементів. Маса нейтрона близька до маси протона.Електричний заряд у протона відсутніхД.Д.Іваненкосформулювавпротоно-нейтроннуконцепціюбудови атомного ядра, щопотімрозробивВ.Гейзенберг. Ядра, щоскладаються з протонів і нейтронів одержали назву нуклонов. Зіткенняелектрона і позитрона призводить до анігіляції - їхньогоперетворення в два фотони, виспускає у протилежнихнапрямках.
Ядерна взаємодія ЯдернувзаємодіюможнаприблизноописатипотенціаломЮкави:
де U — потенціалвзаємодії, g — константа, щоописуєінтенсивністьвзаємодії, k — величина оберненарадіусуядерноївзаємодії. Цейпотенціаланалогічнийекранованомукулонівськомупотенціалу. Ядернавзаємодіявідповідає за притяганнянуклонів у складі ядра.Вона протидієкулонівськомувідштовхуваннюзарядівпротонів. Оскількиядернавзаємодіязростаєіззбільшеннямзарядового числа ядра повільніше, ніжкулонівська, ядрам ізбільшим зарядом потрібнобільшенейтронів для забезпеченнястабільності. Однак, нейтрон нестабільначастинкащодослабкоївзаємодії, тому ядра атомівіз великиматомним номеромнестабільніщодорадіоактивногорозпадуабоподілу
|
||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

 .
. і
і  не складно. Що тоді можна визначити із експерименту?
не складно. Що тоді можна визначити із експерименту? молекул у фазовому просторі їх координат x і імпульсів p. Функція розподілу задовольняє кінетичного рівняння:
молекул у фазовому просторі їх координат x і імпульсів p. Функція розподілу задовольняє кінетичного рівняння: 


 ,
, - рівноважна функція розподілу, що залежить лише від швидкостей частинок і відома з термодинаміки, а
- рівноважна функція розподілу, що залежить лише від швидкостей частинок і відома з термодинаміки, а  - невелике відхилення.
- невелике відхилення.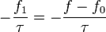 ,
, .
.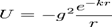 ,
,


