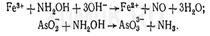Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дробный метод исследования. Теоретические положения. Выбор объектов исследования. Схема дробного метода анализа (по О.М. Крыловой).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основоположником дробного методу аналізу є радянський учений Н. А. Тананаєв. Велика заслуга в розробці методик дробового аналізу «металевих отрут» і впровадженні цих методик в практику хіміко-токсикологічного аналізу належить А. Н. Крилової і співроб. Дробний метод заснований на застосуванні реакцій, за допомогою яких у будь-якій послідовності можна виявити шукані іони в окремих невеликих порціях досліджуваного розчину. Користуючись дробним методом, відпадає необхідність виділення досліджуваних іонів з розчинів. Для виявлення відповідних іонів дробним методом необхідно застосовувати специфічні реактиви, що дозволяють виявити шуканий іон в присутності сторонніх іонів. Однак не завжди можна підібрати специфічні реакції для виявлення шуканих іонів. У цих випадках у дробному аналізі користуються спеціальним прийомом (маскуванням), за допомогою якого усувається вплив заважають іонів. Виявлення шуканих іонів дробним методом проводиться в два етапи. Спочатку усувають вплив заважають іонів за допомогою відповідних реактивів або їх сумішей, а потім додають реактив, що дає забарвлення чи осад з шуканим іоном.
78. Характеристика реагентов, которые используются в дробном методе для маскировки ионов, которые мешают, выделения и анализа "металлических'" ядов. Маскування іонів є однією з найважливіших операцій в дробному аналізі. Маскуванням називається процес усунення впливу заважаючих іонів, що знаходяться в складній суміші, на виявлення шуканих іонів. При маскуванні іони, які заважають, переводять в сполуки або в інші іони, які втрачають здатність реагувати з реактивами на шукані іони. Існує кілька способів маскування іонів. З метою маскування іони, що заважають, переводять у стійкі комплекси, змінюють валентність цих іонів за допомогою окислювачів або відновників, змінюють рН середовища і т. д. Основним способом маскування заважаючих іонів, який застосовується в аналітичній хімії та в хіміко-токсикологічному аналізі, є комплексоутворення. Користуючись цим способом, для маскування підбирають такий реактив, який з даними іонами утворює безбарвні міцні комплексні іони, не здатні реагувати з реактивами на шукані іони. Використання комплексоутворення для маскування іонів можна показати на кількох прикладах.
1. Для виявлення іонів Со 2 + застосовують роданід амонію. При цьому утворюється сполука (NH 4) 2 [Co (SCN) 4], що має синє забарвлення. Виявленню іонів Со 2 + роданідом амонію заважають іони заліза (III), які з цим реактивом дають криваво-червоне забарвлення. Для усунення небажаного впливу іонів заліза (III) до суміші, яка містить іони кобальту і заліза, додають розчини фторидів або фосфатів, які переводять іони заліза (III) в безбарвний комплекс [FеF 6] 3 -, який не реагує з роданідом амонію. Таким чином, після маскування іонів заліза (III) фторидами або фосфатами можна легко виявити іони кобальту, що знаходяться в суміші з іонами заліза, використовуючи роданід амонію. Демаскування іонів. Демаскуванням називають процес звільнення раніше замаскованих іонів від маскуючих реактивів. У результаті демаскування раніше замасковані іони відновлюють здатність вступати в реакції з відповідними реактивами. Демаскування в основному здійснюється розкладанням комплексних іонів, які раніше утворилися в процесі маскування.
Маскуючі реактиви: 1. Ціаніди. Застосування ціанідів для маскування іонів засноване на тому, що з їх допомогою заважають іони можна перевести в комплекси: [Co(CN)6]4-, [Fe(CN)6]4-, [Fe(CN)6]3-, [Ni(CN)4]2-, [Zn(CN)4]2-, Cd(CN)4]2-, [Hg(CN)4]2-, [Ag(CN)2]-. Освіта ціанідні комплексів міді відбувається в 2 етапи. Спочатку відновлюються іони міді (II), а потім утворюється комплексний іон:
2. Фториди. Фториди часто використовуються для маскування іонів заліза (III), з якими вони утворюють безбарвні стійкі комплексні іони [FEF 6] 3 -. 4. Тіосульфати. Тіосульфати застосовуються для маскування іонів срібла, свинцю, заліза (III), міді та інших катіонів. При взаємодії тіосульфатів з перерахованими іонами утворюються комплекси:
[Ag2(S2O3)3]4-, [Pb(S2O3)3]4-, [Fe(S2O3)2]-. 5. Гідроксиламін. Маскуюча дія гідроксиламіну заснована на тому, що з одними іонами він утворює комплекси, а з іншими - вступає в реакції окислення-відновлення. З іонами кобальту гідроксиламін утворює комплекс [Co (NH 2 OH) 6] 2 +. Залежно від природи іонів, з якими реагує гідроксиламін, він може бути окислювачем і відновником. Гідроксиламін відновлює іони заліза (III) і окисляє іони AsO 2 - і SBO 2 -:
Для зв'язування надлишку гідроксиламіну застосовують формальдегід, з яким він утворює формальдоксим:
7. Гліцерин. З катіонами вісмуту, свинцю, кадмію та іншими гліцерин утворює гліцерати:
8. Комплексон III (трилон Б) широко застосовується в кількісному аналізі. Однак цей реактив досить часто використовується і для маскування іонів кадмію, кобальту, міді, заліза, марганцю, свинцю, цинку, магнію і ін.
9. Лимонна кислота і її солі (цитрати) з катіонами низки металів дають міцні сполуки, будову яких можна виразити наступними формулами:
У дробному аналізі лимонна кислота використовується для маскування іонів вісмуту, міді, заліза (III), сурми (III), кадмію, ртуті, срібла та деяких інших. 10. Аскорбінова кислота використовуються в аналізі для маскування іонів заліза (III), олова (IV) та ін.
76. Общая характеристика методов количественного анализа "металлических'" ядов в дробном анализе. Выбор метода в зависимости от содержания яда. Типичные ошибки при проведении анализа. 77. Судебно-медицинская оценка результатов химико-токсикологического исследования с учетом природного содержания металлов в организме. 78. Группа соединений, которые определяются непосредственно в биологическом материале или нуждаются в особенных методах изолирования (оксид углерода (ІІ), фториды). Общая характеристика группы. Физико-химические свойства, строение и действие на организм.
|
||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 618; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.161.119 (0.011 с.) |