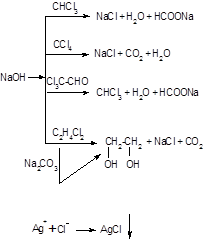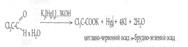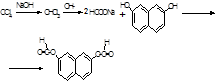Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первая помощь при отравлении спиртами и методы детоксикации организма.Содержание книги
Поиск на нашем сайте
Клініка отруєння метиловим спиртом. Антидотом метанолу є етанол. Його призначають з розрахунку 1-2 г 96 ° алкоголю на 1 кг ваги/24 години протягом 3-4 діб і більше. Шляхи введення етанолу не мають принципового значення (всередину або в / в), важливо щоб вводима доза рівномірно розподілялася протягом доби і всього курсу лікування. При в / в введення можна користуватися 5% розчином спирту на глюкозі, всередину призначають по 40-50 мл 30-40 ° спирту або горілки через кожні 3 години. Крім цього, хворим вводять солі кальцію, мета призначення яких полягає у компенсації втрат кальцію при внутрішньоклітинному утворенню оксалатів під впливом метанолу. Неспецифічна детоксикація і симптоматична терапія проводяться за загальноприйнятими показаннями і включають форсований діурез, корекцію водного та електролітного обмінів, а також КОС. Отруєння етанолом. При застосуванні внутрішньо увеликих дозах можливе пригнічення діяльності дихального центру. При застосуванні внутрішньо або внутрішньо венно у великих дозах швидко розвивається кома (холодна липка шкіра, гіперемія обличчя, зниження температури тіла, блювання, мимовільне виділення сечі та калу, звуження зіниць, а при прогресу ванні порушення дихання – розширення. Горизонтальний ністагм, дихання уповільнене, пульс частий, слабкий). Іноді – судоми, аспірація блювотних мас, ларингоспазм. Можлива зупинка дихання внаслідок механічної асфіксії з подальшим пригніченням серцево-судинної діяльності. При отруєнні внаслідок прийому етанолу внутрішньо викликають блювання, промивають шлунок. При необхідності вживають реанімаційні заходи.
При отруєнні етанолом проводять промивання шлунку, призначають ентеросорбенти, викликають блювання. У разі необхідності проводять оксигенотерапію, форсований діурез. в/в призначають 40% р-н глюкози, тіамін. 42. Алкилгалогениды. Физико-химические свойства хлороформа, четиреххлористого углерода, хлоральгидрата. Использование, токсическое действие на организм. Основные закономерности поведения в организме. Особенности изолирования из органов трупа и биологических жидкостей. Хлороформ ( трихлорметан) СНCl 3 - безбарвна прозора летюча рідина з характерним запахом. Змішується з діетиловим ефіром, етиловим спиртом і іншими органічними розчинниками, слабо розчиняється у воді. Під впливом світла, повітря, вологи і температури хлороформ поступово розкладається. При цьому можуть утворюватися фосген, мурашина і соляна кислоти. Хлороформ широко використовується в хімічній промисловості та в хімічних лабораторіях як розчинник. Раніше він застосовувався в медицині для наркозу. В даний час хлороформ в суміші з іншими лікарськими препаратами використовується для розтирання. Пари хлороформу легко проникають в організм з повітрям. Хлороформ діє на центральну нервову систему, викликаючи наркоз. Він накопичується в тканинах, багатих жирами. При великих кількостях хлороформу, що надійшов в організм, можуть з'являтися дистрофічні зміни у внутрішніх органах, особливо в печінці. При отруєнні хлороформом смерть настає від зупинки дихання. Метаболізм. Хлороформ, що надійшов в організм, швидко зникає з крові. Через 15-20 хв з повітрям, що видихається в незміненому вигляді виділяється 30-50% хлороформу. Протягом години через легені виділяється до 90% хлороформу, що надійшов в організм. Однак ще й через 8 год в крові можна виявити незначні кількості хлороформу. Частина хлороформу піддається біотрансформації. При цьому в якості метаболітів утворюються оксид вуглецю (IV) і хлороводень. При хіміко-токсикологічних дослідженнях основними об'єктами аналізу на наявність хлороформу в організмі є повітря, що видихається, багаті жирами тканини трупів і печінку.
Хлоралгідрат - безбарвні кристали або дрібнокристалічний порошок з характерним гострим запахом і злегка гіркуватий, розчиняється у воді, етиловому спирті, ефірі і хлороформі. Хлоралгідрат гігроскопічний і повільно випаровується на повітрі. Хлоралгідрат застосовується в медицині як заспокійливий, снодійний і анальгезуючий засіб. У великих дозах може викликати отруєння. За токсичного дією близький до хлороформу. Він застосовується при психічних збудженнях і як протисудомний засіб при правці, еклампсії і при інших захворюваннях. У певних дозах хлоралгідрат застосовується як снодійний засіб. Чотирихлористий вуглець ССl 4 - прозора рідина зі своєрідним запахом (т. кип 75-77 ° С).. Він змішується в будь-яких співвідношеннях з ацетоном, бензолом, бензином, сірковуглецем та іншими органічними розчинниками. У воді при 20 ° С розчиняється близько 0,01% чотирихлористого вуглецю. Не вогненебезпечний, його пари в кілька разів важчі за повітря. Широко застосовується в промисловості як розчинник жирів, смол, каучуку. Він використовується як консервант при обробці хутра, а також застосовується для видалення жирних плям з одягу. Чотирихлористий вуглець входить до складу рідин для наповнення вогнегасників. Метаболізм. Чотирихлористий вуглець швидко виділяється з організму. Вже через 48 годин після надходження в організм його не можна виявити у видихуваному повітрі. Його метаболітами є хлороформ і оксид вуглецю (IV). Хлоралгідрат - безбарвні кристали або дрібнокристалічний порошок з характерним гострим запахом і злегка гіркуватий, розчиняється у воді, етиловому спирті, ефірі і хлороформі діетиловому. Хлоралгідрат гігроскопічний і повільно випаровується на повітрі. Хлоралгідрат застосовується в медицині як заспокійливий, снодійний і анальгезуючий засіб. У великих дозах хлоралгідрат може викликати отруєння. За токсичністю дії хлоралгідрат близький до хлороформу. Він застосовується при психічних збудженнях і як протисудомний засіб при правці, еклампсії і при інших захворюваннях. У певних дозах хлоралгідрат застосовується як снодійний засіб.
Відомі два ізомери дихлоретану (З2Н4Сl2): 1,1-дихлоретан і 1,2-дихлоретан. Сl-СН=ССl2. 1,2-Дихлоретан є більш токсичним, ніж 1,1-дихлоретан. У промисловості 1,2-дихлоретан використовується як розчинник жирів, воску, смол, парафінів і інших речовин. Його застосовують і в хімічних лабораторіях для екстракції багатьох органічних речовин з водних розчинів. 1,2-Дихлоретан використовується для витягання жиру з шерсті тварин, для хімчистки одягу. Пари 1,2-дихлоретану проникають в організм через дихальні шляхи. Цей препарат в рідкому стані може проникати в організм через неушкоджену шкіру. Відомі випадки отруєння 1,2-дихлоретаном, помилково прийнятим всередину замість спиртних напоїв. Картина отруєння 1,2-дихлоретаном подібна картині отруєння чотирьоххлористим вуглецем. 1,2-Дихлоретан викликає ураження центральної нервової системи, печінки, нирок і серцевого м'яза. Після прийому токсичної дози 1,2-дихлоретану всередину спостерігаються блювота, пронос, болі в області печінки, здуття живота, уремія. 15-50мл 1,2-дихлоретану в більшості випадків викликають смерть. У літературі є відомості про те, що 1,2-дихлоретан надає канцерогенна і мутагенна дія на організм/
43. Химические реакции определения алкилгалогенидов, оценка их чувствительности и специфичности. 1. загальна проба – відщеплення іонів хлору (неспецифічна, високочутлива):
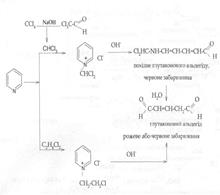
2. загальні (чутливі) реакції: - реакція Фудживара (чотири хлористий вуглець, хлороформ, хлоралгідрат, дихлоретан) – неспецифічна, чутлива:
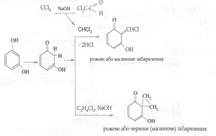
Утворюється рожеве або червоне забарвлення - Реакція з резорцином (чотири хлористий вуглець, хлоралгідрат, хлороформ, дихлоретан) – неспецифічна, чутлива:
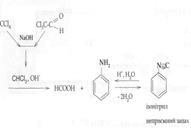
Утворюється рожеве або малинове (червоне) забарвлення. - Ізонітрильна проба (чотири хлористий вуглець, хлороформ, хлоралгідрат) – неспецифічна, високочутлива:
Відчувається різкий запах ізонітрилу. 3. найбільш специфічні реакції: - з реактивом Фелінга (хлороформ, хлоралгідрат) – специфічна, низько чутлива:
- З реактивом Неслера (хлоралгідрат) – специфічна, чутлива:
- з діоксинафталіном (чотири хлористий вуглець, хлороформ) – специфічна, чутлива
Світло-буре забарвлення переходить у зелено-жовте, для хлороформу – темно-червоне - реакції для ціле направленого аналізу на наявність дихлоретану – специфічні, чутливі:
|
||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 424; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.28.200 (0.012 с.) |