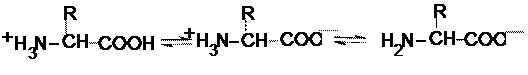Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізико-хімічні властивості амінокислот та білківСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Кожна амінокислота, крім гліцину, містить один чи більше асиметричних атомів карбону, тобто проявляє оптичну активність. За абсолютною конфігурацією амінокислоти в організмах належать до L-ряду. Лише у складі пептидів деяких мікроорганізмів зустрічаються D-амінокислоти, наприклад в токсині ботулізму. Амінокислоти - слабкі електроліти. Вони містять групи як кислотного, так і основного характеру, тобто є біполярними йонами. Їх заряд залежить від кількості цих груп і рН середовища: рН< 7 рН»7 рН>7
катіон біполярний йон аніон
Властивості білків визначаються хімічним складом, розмірами і формою молекули. Білки мають молекулярну масу від 6 тисяч до мільйону і більше. Розчинність. Більшість білків розчиняється у воді. Розчинність білків супроводжується їх гідратацією й набуханням. Деякі білки (глобуліни) у воді нерозчинні, але розчинні при додаванні розчинів нейтральних солей. При додаванні солей до розчинів деяких інших білків розчинність білків знижується, і вони випадають в осад. Цей процес має назву висолювання. Висолювання має зворотній характер – при видаленні з розчину йонів солі білок знову переходить у розчин. За певних умов структура білка може бути зруйнована. Це відбувається при денатурації. Денатурація - втрата білком своїх природних властивостей під впливом деяких факторів (температура, тиск, рН-середовище, випромінювання, дія органічних та неорганічних кислот, лугів, солей важких металів). Найбільш типовими ознаками денатурації білка є втрата біологічної активності. Це відбувається через порушення четвертинної, третинної, вторинної структури білків. З явищем денатурації ми стикаємось часто в повсякденному житті: теплова денатурація при бланшуванні рослинної сировини, сушінні зерна, плодів овочів, випічці хліба, одержанні макаронних виробів. Якісні та кількісні визначення білків. Присутність білків у харчових об’єктах визначається за допомогою якісних реакцій, які умовно поділяють на дві групи: Ø кольорові реакції Ø реакції осадження. Перша група Біуретова реакція — поява фіолетового чи синьо-фіолетового забарвлення у разі обробки сильнолужного розчину білка кількома краплинами насиченого розчину мідного купоросу СuSO4 Це єдина реакція, яку дають усі сполуки, що містять зв'язки —СО—NН— (зокрема біурет). Чутливість реакції невелика. Більша частина кольорових реакцій білків зумовлена наявністю певних угрупувань у бічних ланцюгах амінокислотних залишків. Наступна реакція зумовлена фенольними залишками тирозину. Ксантапротеїнова реакція — поява жовтого забарвлення в разі обробки концентрованого нітратною кислотою на холоді, а іноді під час нагрівання. У разі добавляння їдкого лугу забарвлення посилюється, стає померанчевим (утворення нітрофенолятів). Друга група – білки осаджують дією солей, органічних розчинників, конц розчинів кислот, солей, йонів важких металів, температури і в ізоелектричній точці. Білки в розчині достатньо нестійкі, тому при додаванні зазначених реагентів гідратна оболонка білку руйнується і вони випадають в осад Методи виділення. Загальна схема: подрібнення (гомогенізація), екстрагування і виділення, тобто очищенню та отримання білку в індивідуальному стані. В практиці для виділення і очищення білків використовують різні типи хроматографії (адсорбційна розподільча, йоннообмінна), гель-фільтрація, електрофоретичне розподілення. Вміст білку в харчових продуктах визначаються по кількості азоту методом Кьєльдаля.
Класифікація білків
Приклади білків: Альбумін - яєчний білок кератин - роги, шерсть колаген - шкіра гемоглобін - кров фібрин, фібриноген - кров пепсин - шлунковий сік трипсин - підшлунковий сік міозин - м'язи глобулін - вакцина родопсин - зоровий пурпур ліозин - слина інсулін - підшлункова залоза Єдиної науково обґрунтованої системи класифікації білків немає. Білки часто класифікують за випадковими ознаками – за біологічними функціями, джерелом виділення, формою молекул білка. За складом білки поділяють на прості (протеїни), які складаються лише з амінокислотних залишків, і складні (протеїди), які містять, крім білка, компонент небілкової природи. Серед простих білків виділяють групи, представники яких мають подібний склад, молекулярну масу, властивості та функцію: Протеїни: 1) Альбуміни – розчині у воді, не розчинні в концентрованих розчинах солей. рI= 4.6-4.7. Існує альбумін молока, яєць, сироватки крові. входять до складу різних рідин організму (сироватка крові, лімфи), до складу продуктів харчування (молока, яєць, зерна злакових та бобових культур). Беруть участь у транспортуванні різних речовин: ліпідів, жирних кислот. 2) Глобуліни – не розчинні у воді, розчинні в сольових розчинах. Відомі глобуліни молока, яєць 3) Гістони – розчинні у воді, в слаб. концентрованих кислотах. Проявляють виражені основні властивостями. Це ядерні білки, вони пов'язані з ДНК і РНК. 4) Склеропротеїни – білки опорних тканин (хрящів, кісток), вовни, волосся. Не розчинні у воді, слабких кислотах і лугах. а) колагени – фібрилярні білки сполучної тканини. При тривалому кип’ячені вони розчиняються у воді і при застиганні утворюється желатин. б) еластини – білки зв'язок і сухожиль. За властивостями схожі на колаген, але піддаються гідролізу під дією ферментів травного соку; в) кератин – входить до складу волосся, пір'я, копит; г) фіброїн – білок шовку, в складі містить багато серину; д) проламіни і глютеніни – білки рослинного походження. Містять велику кількість глютамінової кислоти та лізину. Складні білки поділяють на групи залежно від природи їх небілкової частини: глікопротеїди – складні білки молекули яких містять залишки вуглеводів. багато білків сполучної тканини, крові, зовнішньої поверхні клітинних мембран; ліпопротеїди – містять залишки ліпідів. Форма транспорту ліпідів в крові, інтегральні білки мембран, нуклеопротеїди – молекули сполучені з НК хромосоми, рибосоми; фосфопротеїни – містять залишки фосфорної кислоти, поживний білок молока казеїн; металопротеїни - містять безпосередньо атоми металу, а не металоорганічні комплекси типу гему. До них належать металоферменти, форми запасання і транспорту металу феритин (Fe), церулоплазмін (Cu), металотіонеїн (Zn, Cu, Cd)); хромопротеїди – містять забарвлену органічну групу (гем, рибофлавін). Протеноїди – входять до складу тваринних тканин і виконують в основному механічну і опорну функції. За біологічними функціями: Структурні білки. Колаген – є основним компонентом хрящів, сухожилля, шкіри, кісток. Колаген є у всіх багатоклітинних організмах, крім рослин. У людини його частка складає близько 5 % маси тіла і третину маси всіх білків організму. Це позаклітинний білок з унікальними властивостями. Його молекула витримує навантаження, вага якого в десятки тисяч разів більша від ваги білкової молекули. Тобто ці молекули міцніші, ніж сталевий дріт. Колаген бере участь у формуванні організму. Він визначає напрямок і швидкість зростання клітинних елементів у організмі під час його росту і зберігає та підтримує набуту форму протягом життя. При старінні організму кількість поперечних зшивок, а отже, і жорсткість структури колагену, зростає. Це погіршує якість сполучної тканини, наприклад, робить більш ламкими кістки, менш прозорою рогівку ока. При кип’ятінні м’язової тканини (м’яса) частина пептидних зв’язків у колагені піддається гідролізу. При цьому утворюється суміш пептидів, що називається желатином. Тривалість приготування м’ясних страв визначається умовами руйнування волокон колагену. Кератин – входить до складу сполучної і покривної тканин, волосся, пір’я, рогів. Еластин – входить до складу еластичних тканин і виконує структурні функції. З нього побудовані внутрішні оболонки судин. Особливості хімічного складу і будови білків реалізуються у виконанні ними певних біологічних функцій. З’ясуємо цю залежність на прикладі окремих функцій білків.
Скорочувальні білки: Найкраще вивчені скорочувальні комплекси м’язових клітин. Вони складаються з білків двох типів - актину і міозину. Транспортні білки утворюють комплекси з речовинами, які вони транспортують між тканинами або через мембрану. Ця функція та її регуляція найдосконаліше вивчена для дихальних білків - переносників кисню. Дихальні білки поширені починаючи від дріжджів і до вищих хребетних. У клубеньках бобових також знайдений дихальний білок. Усі вони зворотньо приєднують молекули кисню (зв’язують його при високому вмісті в середовищі та віддають при пониженому). Дихальні білки містять йон заліза, рідше міді (молюски та більшість членистоногих), який бере участь у зв’язуванні кисню. Гемоглобіни і міоглобіни містять залізо (Fe2+) у складі небілкової частини – гему. Гем – це плоска система, яка складається з порфіринового кільця, утвореного чотирма пірольними гетероциклами, що містять замісники, та з’єднані між собою через метинові зшивки, і йону заліза.
Захисні білки – антитіла відіграють важливу роль у захисті організму від чужорідних речовин та клітин. Антитіла - це імуноглобуліни, які виробляються клітинами імунної системи лімфоцитами і входять до складу сироватки крові та інших позаклітинних рідин, а також поверхні деяких клітин, наприклад, лімфоцитів. Організм виробляє антитіла на чужорідні білки, полісахариди, інші речовини, наприклад, нітрофенол, на ракові клітини, пилок рослин тощо. Антитіла проявляють високу специфічність до свого антигену. У нормі первинна дія імуноглобулінів повинна проявлятись вчасно, специфічно, адекватно за силою реакції та обмежено в часі. Однак, часто зустрічаються порушення імунної системи, які проявляються у гіперчутливості імунної реакції, або імунодефіцитності. Існують також захворювання, при яких імунна система організму починає працювати проти себе (аутоімунозахворювання). Порушення можуть виникати як наслідок дії радіоактивного опромінення, а також частого введення вакцин. На початку 80-х років було виявлено невиліковне на наш час захворювання - синдром набутого імунного дефіциту (СНІД). У 1984 р. з’ясували, що ця патологія викликається вірусом, який руйнує лімфоцити.
Залежно від форми білкової молекули: Фібрілярні білки (табл.15) - утворені поліпептидними ланцюгами, які розташовані паралельно один одному уздовж однієї осі і утворюють довгі волокна (фібрили) або шар. Не розчинні у воді та розчинах солей. Основні структурні елементи сполучної ткани (коллаген та ін.).
Таблиця 15. Структура та властивості фібрилярних білків
Глобулярні білки - білки, у молекулах яких поліпептидні ланцюги щільно згорнуті в компактні кулясті структури (глобули). До глобулярних білків належать ферменти, антитіла, деякі гормони та інші білки, що виконують у клітках динамічні функції.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 615; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.134.196 (0.008 с.) |