Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярні механізми реалізації спадкової інформаціїСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
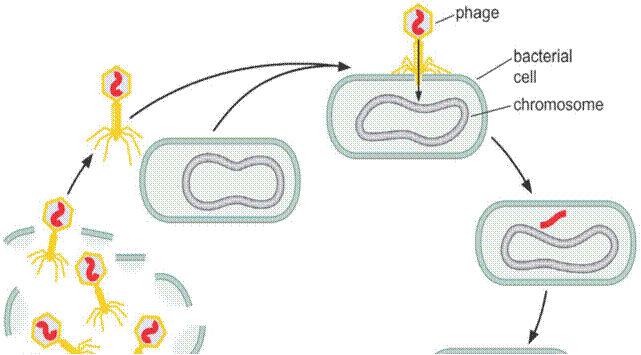
Молекулярні механізми реалізації спадкової інформації Рис.1.- Процес проникнення ДНК донорних бактеріальних клітин у клітини-реципієнти Інший прямий доказ ролі ДНК у спадковості одержаний при вивченні розмноження бактеріофага Т 2, що інфікує кишкову паличку Escherichia coli під час трансдукції. Трансдукція (от лат. transductio — переміщення) — процес перенесення бактеріальної ДНК з однієї клітини в іншу завдяки бактеріофагу. Фаги здатні до реалізації двох шляхів розвитку в бактеріальній клітині: 1) літичний — після потрапляння в бактерію ДНК фага відразу ж починається його реплікація, синтез білків і складання готових фагових часток, після чого відбувається лізис клітини (рис.2). Фаги, що розвиваються тільки за таким сценарієм, називають вірулентними; 2) лізогенний — ДНК фага, що потрапила в бактеріальну клітину, вбудовується в її хромосому чи існує в ній як плазміда, реплікуючись при кожному поділі клітини. Такий стан бактеріофага носить назву профаг. Система його реплікації в цьому випадку пригнічена синтезуємими ним самим репресорами. При зниженні концентрації репресора профаг індукується і переходить до літичного шляху розвитку. Бактеріофаги, що реалізують подібну стратегію, називаються помірними. Для деяких з них стадія профага є обов'язковою, інші в деяких випадках здатні відразу розвиватися за літичним шляхом. Для вивчення процесу трансдукції та доказів ролі ДНК у спадковості в якості об'єкта генетичних досліджень був використаний один з вірусів бактерій — бактеріофаг Т 2, що складається лише з білкової оболонки, або чохла — капсиду, і упакованої в нього молекули ДНК (з’ясовано за допомогою електронної мікроскопії). Через 20 хвилин після інфікування при 370 С клітина бактерії лізірується, при цьому біля 100 дочірніх часток фага виходять назовні. Експеримент був спланований таким чином, щоб з'ясувати, що саме — білок або ДНК є носієм спадкової інформації. Альфред Херші (американський бактеріолог і генетик, лауреат Нобелівської премії з фізіології і медицини 1969 року «за відкриття, що стосуються механізму реплікації і генетичної структури вірусів») і Марта Чейз вирощували дві групи бактерій: одну групу вирощували на середовищі, що містить радіоактивний ізотоп фосфору Р32 у складі фосфат-іону, іншу — в середовищі з радіоактивною сіркою-35 у складі сульфат-іону. Бактеріофаги, додані в середовище з бактеріями і размножені в них, поглинали ці радіоактивні ізотопи, які служили маркерами, при побудові своєї ДНК і білків. Фосфор міститься в ДНК, але відсутній у білках, а сірка, навпаки, міститься в білках (точніше, у складі двох амінокислот: цистеїну та метіоніну), але її немає в ДНК. Таким чином, одні бактеріофаги містили мічені сіркою білки, а інші — мічену фосфором ДНК. Після виділення радіоактивно-мічених бактеріофагів їх додавали до культури свіжих (які не містять ізотопів) бактерій і дозволяли бактеріофагам інфікувати ці бактерії. Після цього середовище з бактеріями піддавали енергійному струшуванню у спеціальному змішувачі (було показано, що при цьому оболонки фага відокремлюються від поверхні бактеріальних клітин), а потім інфікованих бактерій відокремлювали від середовища. Коли в першому досліді до бактерій додавалися мічені фосфором-32 бактеріофаги, виявилося, що радіоактивна мітка перебувала в бактеріальних клітинах. Коли ж у другому досліді до бактерій додавалися бактеріофаги, мічені сіркою-35, то мітка була виявлена у фракції середовища з білковими оболонками, але її не було в бактеріальних клітинах. Це підтвердило, що матеріалом, яким інфікувалися бактерії, є ДНК. Оскільки всередині інфікованих бактерій формуються повні вірусні частки, що містять білки вірусу, цей дослід був визнаний одним з вирішальних доказів того факту, що генетична інформація (інформація про структуру білків) міститься в ДНК.
Рис. 2. - Схема інфікування фагом Т2 бактеріальної клітини
Трансдукція використовується:
Значна більшість організмів містить ДНК в якості генетичного матеріалу. Лише деякі віруси, наприклад, вірус тютюнової мозаїки (ВТМ) складаються з рибонуклеїнової кислоти (РНК) і білкового капсиду. Генетична роль РНК у ВТМ доведена в експериментах Г.Френкель-Конрата, А.Гірера та інших у кінці 50-х років ХХ століття. Кожна частка ВТМ містить поодинокий ланцюг РНК довжиною 6400 нуклеотидів. Капсид ВТМ складається приблизно з 2130 ідентичних субодиниць, в кожній з яких міститься 158 амінокислотних залишків. Якщо відокремити білковий капсид від РНК ВТМ, то РНК втрачає здатність інфікувати рослинні клітини (на 99,9%). При реконструюванні вірусних часток (змішуванні РНК і білка ВТМ) вони знов стають інфікуючими. Ці особливості ВТМ і були використані в дослідах. Реконструйовані вірусні частки були одержані з РНК стандартного штаму та білка іншого штаму НR. Обидва штами розрізнялися амінокислотним складом білка оболонки віруса: на відміну від штама НR стандартний штам не містив гістидину та метіоніну. Після інфікування рослин із клітин виділяли вірусні частки-нащадки, причому вони за амінокислотним складом білка капсиду та іншими ознаками завжди відповідали тому штаму ВТМ, від котрого брали РНК. Таким чином була показана роль РНК як носія генетичної інформації у віруса тютюнової мозаїки. Таблиця 1 Вміст азотистих основ у ДНК різних біологічних об’єктів (за С.Г. Інге-Вечтомовим, 1989)
Генетичну роль нуклеїнових кислот підтверджує також мутагенний ефект аналогів пуринових і пиримідинових основ для бактерій, а також ультрафіолетового випромінювання з довжиною хвилі 260 нм, яке поглинається азотистими основами.
2.2. Самокопіювання ДНК – процес реплікації Рис.4. - Кільцева та суперспіралізована форма молекули ДНК у бактерій (за Жимульовим, 1998) Реплікація цих хромосом починається з однієї єдиної точки ініціації реплікації (т.і.р.) (рис.2) та прогресує до закінчення реплікації всієї хромосоми; отже, хромосома уявляє собою одну одиницю реплікації – реплікон. У більшості випадків (у бактерій – завжди) реплікація хромосоми відбувається в обидва боки від точки ініціації реплікації (ϴ-тип) (рис.5).
Рис.5.- Схема реплікації кільцевої ДНК - ϴ-тип (тета-тип) Процес реплікації прокаріот завершується утворенням двох дочерніх молекул ДНК. Їхні нуклеотидні послідовності ідентичні нуклеотидним послідовностям материнської подвійної спіралі ДНК. Завершення реплікації відбувається в спеціальних ділянках ДНК. В E. coli вони називаються ter -сайтами та містять коротку послідовність (близько 23 пар) нуклеотидів (рис.6).
Рис. 6. - Дві групи термінації реплікації у E. coli [Жимульов І.Ф., 2002] В E. coli знайдені дві групи ter -сайтів (рис. 6). У першій групі ter -сайтів зупиняється рух першої реплікаційної вилки, в другій групі ter -сайтів – рух другої. Вони розміщуються приблизно в 100 тпн від тієї точки, в котрій зустрічаються вилки реплікації. Для закінчення реплікації ДНК необхідний спеціальний білок. У бактерії E. coli він кодується геном tus. Цей білок розпізнає термінаторну послідовність, зв’язується з нею та зупиняє подальше просування вилки реплікації. Другий шлях, за яким може здійснюватися реплікація дволанцюгових кільцевих молекул ДНК, отримав назву «кільця, що котиться» («rolling circle») - σ – тип (сигма-тип); так реплікуються кільцеві ДНК деяких фагів, вірусів, мітохондрій, плазмід (рис.7). Таким способом утворюється багато нових молекул вірусних ДНК, а також здійснюється статевий процес у бактерій і ампліфікація генів. Реплікація ДНК за типом кільця, що котиться, ініціюється спеціальним ферментом, який кодується ДНК плазміди або бактеріофага; цей фермент розриває один із ланцюгів двохниткової кільцевої молекули в сайті DSO (англ. double-strand origin) (рис.) з утворенням «+»-ланцюга, що призводить до появи однониткових 5'- і 3'-кінців. Ініціаторний білок зв’язується з 5'-фосфатним кінцем розірваного ланцюга, а вільна 3'-OH група служить праймером для синтеза другого ланцюга ДНК-полімеразою III. 5'-кінець витісняється з подвійної спіралі та приєднується до клітинної мембрани; з ним зв'язується фермент ДНК-полімераза ІІІ. По мірі розкручування молекули величина звільненої одноланцюгової матриці від кінця 5' збільшується. На ній синтезується комплементарна дочірня нитка ДНК. У результаті утворюється та поступово подовжується вільний «хвіст». Використовуючи нерозірваний ланцюг як шаблон, реплікується вся кільцева молекула ДНК, заміщуючи розірвану одно ланцюгову ДНК за допомогою кодуємої реціпієнтом хелікази PcrA в присутності фактора ініціації реплікації. Синтез на кільцевій нитці може йти протягом декількох обертів молекули. В результаті довжина утвореної лінійної молекули може перевищувати довжину одного генома. Багаторазово повторений синтез копії ланцюга на кільцевій нитці ДНК призводить до появи лінійної нитки, яка містить кілька повторів того ж самого гена. Таку нитку називають конкатемером. Вона розрізається рестриктазами на частки, довжина яких дорівнює довжині хромосоми (геному). Після появи таких часток вони замикаються в кільцеві хромосоми. Здійснюється такий спосіб реплікації й у випадку переносу плазмідної або хромосомної ДНК від донора до реципієнта в процесі кон'югації у бактерій. Лінійні копії можуть перетворитися в кільцеву молекулу наступним чином. Спочатку ініціаторний білок робить розрив, термінуючи тим самим синтез іншого (провідного) ланцюга. Потім РНК-полімераза і ДНК-полімераза III реплікують одноланцюгову SSO-ДНК (англ. single-stranded origin), формуючи нове дволанцюгове кільце. Після цього ДНК-полімераза I замінює праймер на ДНК, а ДНК-лігаза зшиває кінці, утворюючи тим самим остаточну дволанцюгову ДНК. Механізм реплікації за типом кільця, що котиться, успішно використаний для ампліфікації ДНК з дуже невеликих кількостей ДНК вихідного зразка.
Рис.7. – Схема реплікації ДНК вірусного, бактеріального та еукаріотичного геномів У вірусів, що мають одноланцюгову ДНК, механізм її реплікації той самий, що і в дволанцюгових молекул, проте генетичну значимість в цьому випадку має тільки одна нитка. Цю нитку ДНК позначають знаком +. Коли (+)-нитка надходить у клітину, вона добудовує комплементарну нитку, утворюючи дволанцюгову молекулу ДНК, що містить (+)-нитку та (–)-нитку. Після розмноження вірусів в утворену частку фага включається тільки (+) нитка ДНК. Отже, реплікація може відбуватися або в одному, або в двох напрямках. При односпрямованій реплікації (характерна для еукаріот) уздовж ДНК рухається одна репликаційна вилка. При двобічній реплікації (ДНК бактеріальної хромосоми, вірусів, плазмід, що мають кільцеву форму) від точки початку в протилежних напрямках розходяться дві репликативні вилки. Результати дослідів показали, що розкручування двох комплементарних ланцюгів батьківської ДНК і їх напівконсервативна реплікація відбуваються практично одночасно і починаються в загальній точці початку реплікації, що позначається як локус ori (від англ. origin — початок). В еукаріот ініціація реплікації також відбувається в локусі ori та починається з появи Y-образної структури — реплікативної вилки (У-тип реплікації (ігрек-тип)), утворення якої пов'язане з розкручуванням дуплексу ДНК і локальним поділом її ланцюгів (рис.7). Оскільки два ланцюги дуплексу ДНК антипаралельні, синтез комплементарних ним ниток повинен в одному випадку йти в напрямку 5'-3', а в іншому — в напрямку 3'-5'. Перша нитка називається лідируючою, друга — запізнілою. Всі відомі ДНК-полімерази потребують для своєї активності вільного 3'-ОН кінця, до якого вони приєднують нуклеотиди. У результаті відбувається ріст ланцюга ДНК в напрямку 5'-3'. Як у такому випадку здійснюється синтез ланцюга ДНК в напрямку 3'-5'? Передбачалося, що для цього потрібна якась особлива ДНК-полімераза. Виявилося, що синтез 3'-5'-ланцюгів має перервчастий характер. Слід, однак, відзначити, що в ДНК еукаріотів, як правило, виявляється не один, а безліч локусів ori, що, мабуть, служить необхідною умовою для того, щоб величезні молекули ДНК в хромосомі еукаріотів встигли повністю відреплікуватися за час одного клітинного циклу. Поділ клітин еукаріотів відбувається шляхом мітозу, при цьому, щоб уникнути втрати генетичної інформації, спочатку подвоюється весь ядерний геном в S-фазі клітинного циклу. Тривалість S-фази становить 8 годин. ДНК центромер хромосом реплікується під час середньої стадії мітозу, що передує процесу сегрегації хромосом. Реплікація мітохондріальної та ядерної ДНК відбувається в різні фази клітинного циклу. Незважаючи на те, що загальна послідовність стадій при реплікації ДНК в еукаріотів і прокаріотів однакова, сам процес має незначні відмінності. Так, у еукаріотів під час реплікації ДНК (ядерна) залишається в нуклеосомній конфігурації. Фрагменти ДНК, багаті парами основ Г—Ц (R-смуги еухроматина в ущільненому хроматині), експресують гени «домашнього господарства», які функціонують у всіх клітинах організму. Ці фрагменти реплікуються на ранній стадії S-фази. Ділянки гетерохроматину, багаті парами основ А—Т (G-смуги), експресують невелику кількість генів і реплікуються на пізній стадії S-фази. Гени з великим вмістом пар А—Т, що кодують різні властивості і функціонують лише в певних клітинах, входять до складу факультативного гетерохроматину; їхня реплікація відбувається на ранній стадії S-фази тільки в тих клітинах, в яких вони експресуються, і на пізніх стадіях — в клітинах, де експресії не відбувається. Спостереження за допомогою електронного мікроскопу показали, що реплікація починається не з кінця лінійної молекули. Наприклад, у фага Т7, що має лінійну молекулу ДНК, реплікація починається на внутрішньому ділянці на 17% довжини всієї молекули, від лівого кінця. Рис. 8. - Розрив одного з ланцюгів ДНК за допомогою фермента ДНК-топоізомерази Примітка: А–ДНК-топоізомераза утворює ковалентний зв'язок з однією з фосфатних груп ДНК (верхній ланцюг); Б – у результаті розриву фосфодиефірного зв'язку в одному полінуклеотидному ланцюзі навколо відповідного йому зв'язку іншого ланцюга здійснюється обертання, яке знімає напруженість, спричинену розходженням двох ланцюгів ДНК в області реплікаційної вилки; В– після зняття напруги в спіралі ДНК відбувається спонтанне відділення ДНК-топоізомерази та відновлення фосфодиефірного зв'язку в ланцюзі ДНК. Реплікація у прокаріотів починається з ділянки нуклеїнової кислоти, яка називається точкою ініціації реплікації або оріджином (локус ori, від англ.: origin), де два ланцюги батьківської ДНК відокремлюються один від одного; в місцях розходження полінуклеотидних ланцюжків починається синтез дочірніх ланцюгів. Область спіралі ДНК, яка на початку реплікації розкручується в першу чергу, називають ділянкою початку реплікації. На певній відстані від точки ініціації молекула ДНК містить ділянку, у якому реплікація зупиняється. Ця ділянка ДНК носить назву точки термінації (тобто точки закінчення) реплікації. Ділянку ДНК від точки ініціації реплікації до точки її закінчення утворює одиницю реплікації – реплікон.
На лідируючому ланцюзі неспецифічна РНК-полімераза здійснює синтез невеликої РНК-місткого транскрипту, до якого в подальшому ДНК-полимераза ІІІ буде приєднувати ДНК-місткі нуклеотиди (якщо транскрипт утворився в «неправильному» місці, РНК-аза Н гідролізує його, забезпечуючи вибірковість синтезу). Перед транскриптом на ланцюг ДНК «сідає» хеліказа гер та ЅЅВ-білки. Останні утримують розплетені ланцюги ДНК, не даючи їм ренатурувати, а також прибирають випадкові елементи матричного ланцюга ДНК. Далі приєднується до ланцюга ДНК-полімераза ІІІ. На відстаючому ланцюзі формується складна хеліказа-dnaBdnaC шляхом послідовного приєднання шести білків dnaC та шести білків-dnaB. Сюди ж долучаються білки та праймаза. Формується складна частка – праймосома, яка в комплексі з ДНК-полімеразою ІІІ утворює реплісому. На цей ланцюг також «сідають» ЅЅВ-білки. Перед початком елонгації на кожному ланцюзі виявляється по одній молекулі ДНК-полімерази ІІІ. Ще на початку 70-х років ХХ століття Б. Альбертс і А. Корнберг висловили припущення, що редуплікацію ДНК здійснює комплекс білків - реплісома, аналогічний рибосомі. Крім ДНК-полімераз і вже перелічених факторів до складу реплісоми, що формується в реплікаційній вилці, входять також інші білки, які прямо чи побічно приймають участь у синтезі ДНК. Елонгація здійснюється по-різному на лідируючому та відстаючому ланцюгах. Внаслідок відмінностей в механізмах синтезу копій на двох різних ланцюгах материнської ДНК репликативна вилка асиметрична. З двох синтезованих дочірніх ланцюгів один будується безперервно, його синтез йде швидше, тому цей ланцюг називають провідним (лідируючим). Синтез іншого ланцюга йде повільніше, тому що він збирається з окремих фрагментів, які потребують багаторазового формування, а потім видалення РНК-затравки. Тому цей ланцюг називають запізнілим (відстаючим). Хоча на ньому окремі фрагменти утворюються в напрямку 5'→3', в цілому цей ланцюг росте в напрямку 3'→5'. На лідируючому ланцюзі йде безперервний синтез ланцюга ДНК, шляхом послідовного приєднання нуклеотидів до РНК-транскрипту. Звільнені водневі зв'язки нуклеотидів двох роз'єднаних батьківських ланцюгів служать своєрідними магнітами, що притягають з нуклеоплазми вільні нуклеотиди, які знаходяться в нуклеоплазмі у вигляді дезоксирибонуклеозидтрифосфатів: дАТФ, дГТФ, дЦТФ, дТТФ. Комплементарний нуклеозидтрифосфат утворює водневі зв'язки з комплементарною основою ланцюга материнської ДНК. Потім за участю ферменту ДНК-полімерази він зв'язується фосфодиефірним зв'язком з попереднім нуклеотидом знову синтезованого ланцюга, віддаючи при цьому неорганічний пірофосфат (від 3’-фосфонуклеозиду відщеплюється пірофосфат), а залишений 5’-фосфорнокислий кінець приєднується до 3’-гидроксилу попереднього нуклеотиду. Синтез здійснюється в напрямку 5’-3’ (рис. 10). ДНК-полімераза приєднує черговий нуклеотид до ОН-групи тільки в 3'-положенні попереднього нуклеотида. Тому ланцюг поступово подовжується на її 3'-кінці. Особливістю ДНК-полімерази є її нездатність почати синтез нового полінуклеотидного ланцюга шляхом простого зв'язування двох нуклеозидтрифосфатів, їй необхідний 3'-ОН-кінець будь-якого полінуклеотидного ланцюга, спареного з матричним ланцюгом ДНК, до якого ДНК-полімераза може лише додавати нові нуклеотиди. Такий полінуклеотидний ланцюг називають праймером або затравкою. Праймером для початку синтезу ланцюга ДНК є коротка послідовність РНК, що утворюється на ДНК за участю ферменту РНК-праймази. Довжина праймерів варіює від 10 до 100 нуклеотидів [Дубінін Н.П.; 1986; Яригін Ст. Н. та ін, 1997 ]. Оскільки ДНК-полімераза здатна здійснювати збірку полінуклеотида тільки в одному напрямку – від 5'- до 3'-кінця, то процес реплікації триває на антипаралельних ланцюгах-матрицях ДНК по-різному. На одній із матриць (3'→5') збірка нової ланцюга відбувається безперервно від 5'- до 3'-кінця і вона поступово подовжується на 3'-кінці. Інша ланцюг, що синтезується на матриці (5'→3'), повинен зростати від 3'- 5'-кінця, але це суперечить напрямку дії ферменту ДНК-полімерази. Встановлено, що синтез другого ланцюга ДНК здійснюється також в напрямку від 5'- до 3'-кінця, але не безперервно, а численними короткими фрагментами, що одержали назву фрагментів Оказакі. Так вони названі на честь японського молекулярного генетика Рейджи Оказакі. На відстаючому ланцюзі праймази спочатку синтезують РНК-місткі праймери – затравки, до яких ДНК-полімераза ІІІ приєднує послідовно ДНК-місткі нуклеотиди з утворенням фрагментів Оказакі (по 1000-2000 нуклеотидів кожен). У результаті дочірніій ланцюг ДНК стає фрагментарним і складається з РНК-містких затравок і ДНК-містких фрагментів Оказакі, що чергуються. Для перекладу всього ланцюга на мову ДНК до процесу підключається ДНК-полімераза І, яка за допомогою своєї 3’-екзонуклеазної активності прибирає РНК-місткі праймери, а за допомогою полімеризуючої активності забудовує утворені прогалини ДНК-місткими нуклеотидами. Всі ДНК-місткі фрагменти зшиваються лігазою. Розпочавшись в точці ініціації, реплікація продовжується доти, поки весь реплікон не буде редуплікований. Кільцеві молекули ДНК прокаріотичних клітин мають один локус ori і являють собою цілком окремі реплікони. Еукаріотичні хромосоми містять велику кількість репліконів. Тому подвоєння молекули ДНК починається в декількох точках, що прискорює процес реплікації великих молекул ДНК еукаріотів. У результаті азотисті основи роз'єднаних ланцюгів стають доступними для зв'язування комплементарними нуклеотидами, які надходять з нуклеоплазми.
Рис. 10.- Приєднання чергового нуклеотида до дочірнього ланцюга ДНК, що синтезується за участю ДНК-полімерази: Ф-Ф – пірофосфат Нині встановлено, що процеси, що йдуть в реплікативній вилці, ще більш складні (рис. 11). ДНК-геліказа, дві ДНК-полімерази на обох дочірніх ланцюгах і праймаза на відстаючому ланцюзі утворюють єдиний поліферментний комплекс – реплісому. Відстаючий ланцюг згинається таким чином, що її ДНК полімераза комплексує з ДНК-полімеразою лідируючого ланцюга. Цей вигин підводить 3'-кінець кожного вже синтезованого фрагмента Оказакі до тієї ділянки, де починається синтез нового фрагмента Оказакі. Комплекс геліказа-праймаза-полімераза рухається разом з вилкою реплікації і синтезує нові РНК-праймери. ДНК полімераза на відстаючому ланцюзі просувається вперед разом з репликаційною виделкою і багаторазово використовується для синтезу фрагментів Оказакі. Таким чином, ДНК синтезується однаково ефективно на обох материнських ланцюгах ДНК (матрицях). Ця схема реплікації ДНК отримала назву «моделі тромбона» (рис.11).
Рис. 11.- Схема реплікації ДНК у відповідності з «моделлю тромбона» [Жимульов І.Ф., 2002] Термінація. При двонаправленому синтезі реплікація закінчується в термінус-центрі (terminus C). Вилки, що рухаються назустріч, немов би збивають одна одну. При односпрямованій реплікації процес починається та закінчується в огі С. Знов утворена ДНК прикріплюється до виросту цитоплазматичної мембрани і, за рахунок локального синтезу мембрани дві молекули ДНК розводяться до полюсів клітини. Ці молекули можуть виявитися зчепленими, тобто утворюються катенани (синоним: катемери), що складаються з двох кільцевих молекул, зчеплених механічно. В їхньому від’єднанні беруть участь гіраза та топоізомераза І. Після утворення міжклітинної перетинки між двома молекулами ДНК формуються дві нові дочірні клітини. Процесинг. Відразу після реплікації у новоствореній ДНК в сайтах (ділянках) рестрикції відбувається метилювання аденіну, гуаніну та цитозіну. Це необхідно для мічення власної ДНК і запобігання розрізання ДНК в цих сайтах власними рестриктазами (ендонуклеазами рестрикції). Система рестрикції необхідна для спрямованого знищення чужорідної ДНК (наприклад, вірусної), проникаючої в клітину.
Рис. 12. Напівконсервативна реплікація молекули ДНК Первинна структура дочірнього ланцюга визначається первинною структурою батьківського ланцюга, тому що в основі його утворення лежить принцип комплементарності основ (G ≡ С, А = Т). Ферменти та білки, що беруть участь у реплікації, повинні працювати швидко і точно. Ці умови виконуються з допомогою особливого мультиферментного комплексу. 1). Ініціація реплікації. Синтез ДНК еукаріотів відбувається в S-фазу клітинного циклу. Ініціацію реплікації регулюють специфічні сигнальні білкові молекули - фактори росту. Останні зв'язуються рецепторами мембран клітин, які передають сигнал, що спонукає клітину до початку реплікації. Синтез нових одноланцюгових молекул ДНК може відбутися тільки при розходженні батьківських ланцюгів. У певному сайті (точка початку реплікації) відбувається локальна денатурація ДНК, ланцюги розходяться з утворенням двох реплікативних вилок, що рухаються в протилежних напрямках. В утворенні реплікативної вилки бере участь низка білків і ферментів. Так, сімейство ДНК-топоізомераз (I, II і III), володіючи нуклеазною активністю, бере участь у регуляції суперспіралізації ДНК. Наприклад, ДНК-топоізомераза I розриває фосфоефірний зв'язок в одному з ланцюгів подвійної спіралі і ковалентно приєднується до 5'-кінця в точці розриву (рис. 13).
Рис. 13.- Участь ДНК-топоізомерази I в утворенні реплікативної вилки. 1 - фермент розщеплює один ланцюг ДНК; між залишком тирозину молекули фермента та фосфорним залишком ланцюгу утворюється ковалентний зв'язок; 2 - відбувається локальне розкручування подвійної спіралі за участю ДНК-хелікази; ДНК-топоізомераза I відновлює фосфодиефірний зв'язок По закінченні формування реплікативної вилки фермент ліквідує розрив в ланцюзі і відділяється від ДНК. Розрив водневих зв'язків у дволанцюжковій ДНК здійснює ДНК-хеліказа. Фермент ДНК-хеліказа використовує енергію АТФ для розплетення подвійної спіралі ДНК. У результаті відбувається розкручування ділянки суперспірализованої молекули ДНК. У підтримці цієї ділянки в розкрученому стані беруть участь SSB-білки (від англ.. single strand binding proteins), тобто білки, що зв'язуються з одно ланцюговими нитками ДНК). SSB-білки, не закриваючи азотистих основ, зв'язуються з одноланцюговою ДНК по всій довжині розділених ланцюгів, і таким чином запобігають їх комплементарному скручуванню та утворенню "шпильок". Елонгація Реплікація ДНК здійснюється ДНК-залежними ДНК-полімеразами (рис. 14). Субстратами та джерелами енергії для синтезу продукту служать 4 макроергічні сполуки - дезоксирибонуклеозидтрифосфати дАТФ, дГТФ, дЦТФ і дТТФ, для активації яких необхідні іони магнію. Нейтралізуючи негативний заряд нуклеотидів, вони підвищують їх реакційну здатність. Ферменти проявляють каталітичну активність тільки в присутності попередньо розкрученої матричної дволанцюжкової ДНК. Синтез ланцюгів ДНК відбувається в напрямку 5'→3' зростаючого ланцюга, тобто черговий нуклеотид приєднується до вільного 3'-кінця попереднього нуклеотидного залишку. Синтезуємий ланцюг завжди антипаралельний матричному ланцюгу. Під час реплікації утворюються два дочірні ланцюги, що представляють собою копії матричних ланцюгів. У синтезі еукаріотичних ДНК беруть участь п’ять ДНК-полімераз (α, β, γ, δ, ε). ДНК-полімерази розрізняють за числом субодиниць, молекулярною масою, асоціації з різними допоміжними білками, що прискорюють процес біосинтезу ДНК, і функціональним призначенням. ДНК-полімерази α (альфа), β (бета), δ (дельта), ε (епсилон) беруть участь у синтезі ДНК в ядрі клітин, ДНК-полімераза γ (гамма) - у реплікації мітохондріальної ДНК.
Рис. 14. – Процес реплікації ДНК-полімерази β, δ, ε не можуть ініціювати утворення дочірніх ланцюгів, так як не мають спорідненості до поодинокої нитки ДНК. Ініціює реплікацію ДНК-полімераза α, комплементарна певному сайту одноланцюгової ДНК. Приєднуючись до нього, ДНК-полімераза α синтезує невеликий фрагмент РНК - праймер, що складається з 8-10 рибонуклеотидів. ДНК-полімераза α складається з чотирьох субодиниць. Кожна з субодиниць ферменту виконує певну функцію: "впізнавання" сайту реплікації, синтез праймера (8-10 рибонуклеотидів), синтез фрагмента ланцюга ДНК (близько 50 дезоксирибонуклеотидів). Таким чином, ДНК-полімераза α синтезує олігонуклеотид, що містить приблизно 60 нуклеотидних залишків: перші 8-10 представлені рибонуклеотидами (праймер), а решта - дезоксирибонуклеотидами. Олігонуклеотид, синтезований ДНК-полімеразою α, утворює невеликий дволанцюговий фрагмент з матрицею, що дозволяє приєднатися ДНК-полімеразі δ і продовжити синтез ланцюга в напрямку від 5'- до 3'-кінця по ходу розкручування реплікативної вилки. Оріджини реплікації ДНК хромосоми людини містить приблизно 150 млн. пар нуклеотидів. Реплікація такої великої молекули зі швидкістю 50 нуклеотидів за хвилину йшла б приблизно 800 годин. Тому ініціація синтезу ДНК відбувається в декількох сайтах хромосоми, які називають сайтами ініціації реплікації, або оріджинами (від англ. origin - походження) реплікації (рис. 15).
Рис. 15. - Утворення двох реплікативних вилок, що переміщуються в протилежних напрямках від оріджина Термін "сайт" використовують для позначення будь-якої ділянки геному. Оріджини реплікації мають певну нуклеотидну послідовність. Послідовність ДНК, обмежена двома оріджинами реплікації, називається одиницею реплікації, або репліконом. На оріджинах за участю ДНК-топоізомерази I ініціюється двонаправлена реплікація. Утворюються дві реплікативні вилки, що переміщаються в протилежних напрямках доти, поки не зустрінуться з наступним репліконом, тобто реплікація припиняється, коли зустрічаються дві реплікативні вилки. Метилювання ДНК Після завершення реплікації відбувається метилювання нуклеотидних залишків новостворених ланцюгів ДНК. Метильні групи приєднуються до всіх залишків аденіну в послідовності -GATC-, при цьому утворюється N6-метиладенін, а також можливе метилювання цитозину в послідовності -GC- та утворення N5-метилцитозину. Кількість метильованих основ дорівнює приблизно 1-8%. Модифікація відбувається за участю ферментів, що використовують в якості джерела метильных груп S-аденозилметіонин (SAM). Приєднання метильних груп до залишків аденіну і цитозіну не порушує комплементарності ланцюгів (рис. 16). Наявність метильних груп в ланцюгах ДНК є необхідним для формування структури хромосом, а також для регуляції транскрипції генів. Протягом нетривалого часу в молекулі ДНК послідовності -GATC- метильовані за аденіном тільки в матричному, не в новому ланцюзі. Ця відмінність використовується ферментами репарації для виправлення помилок, які можуть виникати при реплікації.
Рис. 16.- Метилювання залишків аденину в послідовності -GATC-. Протягом декількох хвилин після реплікацції, поки не відбулося метилювання, новий ланцюг ДНК відрізняється від матричного ланцюга 3) Термінація
Рис. 17. Схема розміщення теломер на хромосомі Наявність теломір необхідне для завершення реплікації кінцевих інформативних послідовностей хромосом, тобто для збереження генетичн
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 863; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.19.206 (0.014 с.) |