Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Докази генетичної ролі нуклеїнових кислот (трансформація у бактерій, досліди з вірусами)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
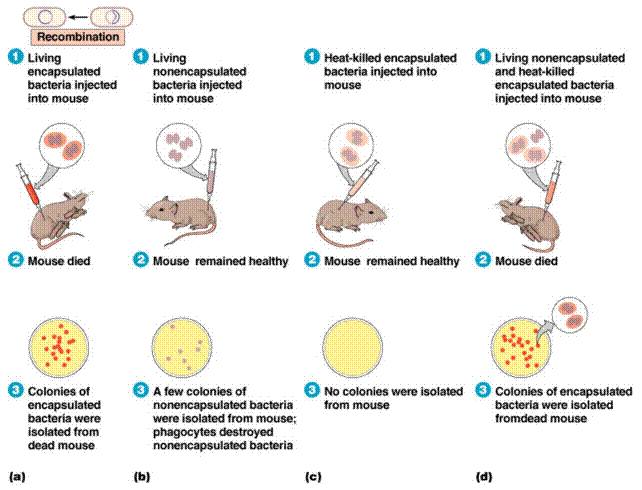
У 19 столітті швейцарський лікар Ф. Мишер опублікував у 1871 році знамениту статтю про выделення нуклеїну з білих клітин крові хворих. Нуклеїн – від латинського «нукс-» — ядро горіха, закінчення «-їн» припускало, що він містить азот, тобто відноситься до азотистих речовин, подібно білкам. До 20-х років ХХ століття вважали, що білок виконує і функцію носія спадкової інформації. Достатньо згадати М. К. Кольцова, вчителя Н. В. Тимофєєва-Ресовського, котрий у 1927 році наголосив про наявність у клітинах «гигантських спадкових молекул» і так званого «матричного синтезу», але білкового! Він вважав, що ген уявляє собою гигантську білкову молекулу, на якій, як на матриці, «відбивається» інша білкова молекула. Суттєву роль у виясненні ролі нуклеїнових кислот у спадкуванні відіграли досліди Ф.Гріффітса (1928), який знайшов у пневмококків (Streptococcus pneumonia) явище трансформації.У 1923 році вийшла з друку невелика робота Ф. Гриффітса, мікробиолога з Оксфорда, в якій він описав явище «трансформації» — перетворення пневмококків, що спричинюють пневмонію. Відомі декілька типів пневмококів, що розрізняються за виглядом і розміром колоній, наявності або відсутності щільної полісахаридної капсули, яка захищає їх від фагоцитозу. При рості на поживному середовищі пневмококи, оточені капсулою, утворюють великі гладкі колонії. Такі пневмококи, віднесені до типу S (від англ. smooth — гладенький), є збудником пневмонії у людини і деяких тварин, у тому числі у мишей. Приблизно одна з 107 клітин пневмококів може спонтанно перетворитися (мутувати) в форму, позбавлену полісахаридної капсули. Безкапсульні пневмококи непатогенні, оскільки швидко знищуються шляхом фагоцитозу в організмі інфікованої тварини або людини. На поверхні поживного середовища такі бактерії, віднесені до типу R (від англ. rough — шорсткий), утворюють дрібні шорсткі колонії, які легко відрізнити від гладких колоній, утворених пневмококами типу S. Пневмококи, крім того, розрізняються за типом поверхневих антигенів, що визначається особливостями капсульного ліпополісахариду (наприклад, тип IIIS, IIR та ін), що служить ще однією важливою успадкованою ознакою. Введення мишам вбитих нагріванням пневмококів типу IIIS або живих пневмококів типу IIR не викликало загибелі тварин. Навпаки, введення живих бактерій типу IIIS, як і передбачалося, призвело до важкої пневмонії і загибелі більшості заражених мишей. Несподіваними виявилися результати дослідів, в яких мишам вводили суміш убитих бактерій типу IIIS і невирулентных пневмококів типу IIR. У цьому випадку більшість тварин також загинули від пневмонії, а з організму загиблих мишей були висіяні живі пневмококи типу IIIS. Таке перетворення некапсульных форм бактерій у вірулентні капсульні не залежало від організму господаря, оскільки спостерігалося і в дослідах in vitro, коли в пробірку, що містить живі R-клітини, додавали вбиті клітини типу IIIS або екстракти з них. В обох випадках при висіванні бактерій з пробірок на чашки Петрі з поживним середовищем формувалися не тільки шорсткі колонії, утворені безкапсульними бактеріями, але виявлялися і гладенькі колонії, що складалися з клітин капсульних бактерій. Частота появи останніх значно перевищувала частоту спонтаного мутування бактерій з IIR-типу в IIIS-тип.
а) 1 – живі капсульні бактерії вірулентні; 2- миші гинуть; 3 – із загиблих мишей виділені капсульні бактерії. б) 1 – живі без капсульні бактерії авірулентні; 2 – миші живі та здорові; 3 – із живих мишей виділені без капсульні бактерії. с) 1 – вбиті нагріванням бескапсульні бактерії авірулентні; 2 – миші живі та здорові; 3- живих бактерій не знайдено. d) 1 – суміш вбитих нагріванням капсульних і живих без капсульних бактерій вірулентна! 2 – миші загинули; 3 – із загиблих мишей виділені капсульні бактерії.
У 1943 р. відбулася важлива подія — визначення хімічної природи гена. «Тут (в лабораторії пневмонії, керівником якої був Освальд Ейвері) виділений ген у чистому вигляді»,- писав в 1943 р. з Рокфеллерівського інституту до себе на батьківщину в Австралію М. Барнет, майбутній нобелівський лауреат у галузі фізіології і медицини (1960 р.). У 1928 р. Ейвері прочитав статтю Ф. Гріффіта і тут же доручив своїм співробітникам перевірити результати роботи англійця. Результати були абсолютно точні, більш того, трансформацію пневмококів можна було здійснювати навіть в пробірці, що відразу ж полегшило завдання вивчення цього молекулярного явища. А в тому, що це було молекулярне явище, О. Ейвері не сумнівався. Разом із М. Маккарті і К. Маклеодом вони, нарешті, довели, що за трансформацію відповідальна «кислота дезоксирибозного типу», про що вони і написали в статті, опублікованої 4 лютого 1944 р. Стало зрозуміло, що ген міститься в ДНК. Для доказу того, що ДНК дійсно є трансформуючою основою в дослідах Гріффітса, препарати ДНК з пневмококів типу IIIS ділили на порції, кожну з яких обробляли дезоксирибонуклеазою (ДНК-аза), рибонуклеазою або протеазою — ферментами, які руйнують відповідно ДНК, РНК або білки, а потім застосовували їх для трансформації клітин типу IIR в тип IIIS. Виявилося, що тільки обробка ДНК-азою повністю знімала трансформуючу активність препаратів ДНК. По мірі очищення ДНК від домішок білка частота трансформації збільшувалася. Це очищення було доведено до такого ступеня, що в препараті ДНК, який повністю зберіг трансформуючу активність, білка було в 10000 разів менше, ніж у ДНК. Обидві групи фактів є доказом того, що генетична інформація, що кодує капсульний полісахарид і його антигенну специфічність у пневмококів, знаходиться в ДНК. Підтвердження цього найважливішого висновку отримали в експериментах А. Херші і М. Чейз (1952) в дослідах з трансдукції (див. Трансдукція). Отже, трансформація – спрямоване перенесення генетичної інформації від донорних клітин у клітини-реципієнти за допомогою ізольованої ДНК. У генетиці бактерій трансформацію використовують для визначення порядка розміщення генів, відстані між ними, побудови генетичних карт і перенесення плазмід у реципієнтні клітини. Картування хромосоми здійснюють за допомогою котрансформації, тобто визначення частоти спільного спадкування двох генів. Якщо два гени знаходяться на значній відстані, вони не можуть локалізуватися в тому ж самому фрагменті трансформованої ДНК, оскільки він маленький. Тому частота котрансформації двох генетичних маркерів служить показником їх зчепленості між собою та їх близького розміщення відносно один одного. Трансформація буває хромосомна (характерна для грам-позитивних бактерій і деяких грам-негативних) та хроматидна (характерна для грам-позитивних і грам-негативних бактерій). Процес трансформації поділяється на декілька стадій:
Стадії проникнення чужорідної ДНК під час трансформації представлені на рис.1. Частота трансформації і здатність ДНК проникати в клітину-реципієнт залежить від концентрації ДНК, виду бактерій, стану клітини-реципієнта. При трансформації у хромосому реципієнта вбудовується невелика ділянка ДНК – 7-8 генів.
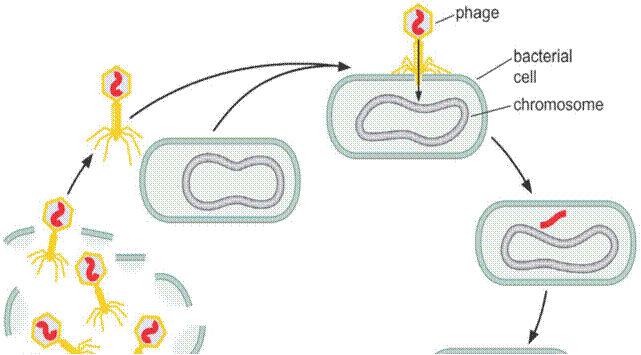
Рис.1.- Процес проникнення ДНК донорних бактеріальних клітин у клітини-реципієнти Інший прямий доказ ролі ДНК у спадковості одержаний при вивченні розмноження бактеріофага Т 2, що інфікує кишкову паличку Escherichia coli під час трансдукції. Трансдукція (от лат. transductio — переміщення) — процес перенесення бактеріальної ДНК з однієї клітини в іншу завдяки бактеріофагу. Фаги здатні до реалізації двох шляхів розвитку в бактеріальній клітині: 1) літичний — після потрапляння в бактерію ДНК фага відразу ж починається його реплікація, синтез білків і складання готових фагових часток, після чого відбувається лізис клітини (рис.2). Фаги, що розвиваються тільки за таким сценарієм, називають вірулентними; 2) лізогенний — ДНК фага, що потрапила в бактеріальну клітину, вбудовується в її хромосому чи існує в ній як плазміда, реплікуючись при кожному поділі клітини. Такий стан бактеріофага носить назву профаг. Система його реплікації в цьому випадку пригнічена синтезуємими ним самим репресорами. При зниженні концентрації репресора профаг індукується і переходить до літичного шляху розвитку. Бактеріофаги, що реалізують подібну стратегію, називаються помірними. Для деяких з них стадія профага є обов'язковою, інші в деяких випадках здатні відразу розвиватися за літичним шляхом. Для вивчення процесу трансдукції та доказів ролі ДНК у спадковості в якості об'єкта генетичних досліджень був використаний один з вірусів бактерій — бактеріофаг Т 2, що складається лише з білкової оболонки, або чохла — капсиду, і упакованої в нього молекули ДНК (з’ясовано за допомогою електронної мікроскопії). Через 20 хвилин після інфікування при 370 С клітина бактерії лізірується, при цьому біля 100 дочірніх часток фага виходять назовні. Експеримент був спланований таким чином, щоб з'ясувати, що саме — білок або ДНК є носієм спадкової інформації. Альфред Херші (американський бактеріолог і генетик, лауреат Нобелівської премії з фізіології і медицини 1969 року «за відкриття, що стосуються механізму реплікації і генетичної структури вірусів») і Марта Чейз вирощували дві групи бактерій: одну групу вирощували на середовищі, що містить радіоактивний ізотоп фосфору Р32 у складі фосфат-іону, іншу — в середовищі з радіоактивною сіркою-35 у складі сульфат-іону. Бактеріофаги, додані в середовище з бактеріями і размножені в них, поглинали ці радіоактивні ізотопи, які служили маркерами, при побудові своєї ДНК і білків. Фосфор міститься в ДНК, але відсутній у білках, а сірка, навпаки, міститься в білках (точніше, у складі двох амінокислот: цистеїну та метіоніну), але її немає в ДНК. Таким чином, одні бактеріофаги містили мічені сіркою білки, а інші — мічену фосфором ДНК. Після виділення радіоактивно-мічених бактеріофагів їх додавали до культури свіжих (які не містять ізотопів) бактерій і дозволяли бактеріофагам інфікувати ці бактерії. Після цього середовище з бактеріями піддавали енергійному струшуванню у спеціальному змішувачі (було показано, що при цьому оболонки фага відокремлюються від поверхні бактеріальних клітин), а потім інфікованих бактерій відокремлювали від середовища. Коли в першому досліді до бактерій додавалися мічені фосфором-32 бактеріофаги, виявилося, що радіоактивна мітка перебувала в бактеріальних клітинах. Коли ж у другому досліді до бактерій додавалися бактеріофаги, мічені сіркою-35, то мітка була виявлена у фракції середовища з білковими оболонками, але її не було в бактеріальних клітинах. Це підтвердило, що матеріалом, яким інфікувалися бактерії, є ДНК. Оскільки всередині інфікованих бактерій формуються повні вірусні частки, що містять білки вірусу, цей дослід був визнаний одним з вирішальних доказів того факту, що генетична інформація (інформація про структуру білків) міститься в ДНК.
Рис. 2. - Схема інфікування фагом Т2 бактеріальної клітини
Трансдукція використовується:
Значна більшість організмів містить ДНК в якості генетичного матеріалу. Лише деякі віруси, наприклад, вірус тютюнової мозаїки (ВТМ) складаються з рибонуклеїнової кислоти (РНК) і білкового капсиду. Генетична роль РНК у ВТМ доведена в експериментах Г.Френкель-Конрата, А.Гірера та інших у кінці 50-х років ХХ століття. Кожна частка ВТМ містить поодинокий ланцюг РНК довжиною 6400 нуклеотидів. Капсид ВТМ складається приблизно з 2130 ідентичних субодиниць, в кожній з яких міститься 158 амінокислотних залишків. Якщо відокремити білковий капсид від РНК ВТМ, то РНК втрачає здатність інфікувати рослинні клітини (на 99,9%). При реконструюванні вірусних часток (змішуванні РНК і білка ВТМ) вони знов стають інфікуючими. Ці особливості ВТМ і були використані в дослідах. Реконструйовані вірусні частки були одержані з РНК стандартного штаму та білка іншого штаму НR. Обидва штами розрізнялися амінокислотним складом білка оболонки віруса: на відміну від штама НR стандартний штам не містив гістидину та метіоніну. Після інфікування рослин із клітин виділяли вірусні частки-нащадки, причому вони за амінокислотним складом білка капсиду та іншими ознаками завжди відповідали тому штаму ВТМ, від котрого брали РНК. Таким чином була показана роль РНК як носія генетичної інформації у віруса тютюнової мозаїки.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1005; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.162.8 (0.015 с.) |