| Фермент
| Среда для детекции
| Положительная реакция
|
| САХАРОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
|
| Амилаза
| Крахмальный агар (агар с 0,2% крахмала) и раствор Люголя.
| При нанесении раствора йода на среду с 18 - 24 часовой культурой микроорганизмов, вокруг колоний с амилазной активностью образуется светлый неокрашенный ореол, в то время как остальная среда приобретает сине-фиолетовый цвет из-за присутствия в ней крахмала.
|
| Карбо-гидразы
| Дифференциально-диагностические среды для энтеробактерий (Эндо, Левина, Плоскирева и др.); содержат лактозу, анилиновые красители.
| Лактозопозитивные энтеробактерии (Escherichia coli, Klebsiella oxytoca, K. pneumonia), образуют ярко окрашенные колонии,
лактозонегнативные энтеробактерии (Salmonella, Shigella) – бледно-розовые или бесцветные колоний.
|
| Полиуглеводные среды (Клиглера, Олькеницкого и др.). Среда Клиглера имеет малиново-красный цвет и содержит: 0,1% глюкозы, 1% лактозы, соли Fe 2+, феноловый красный (индикатор рН).
| При разложении глюкозы желтеет столбик среды, при разложении лактозы желтеет скошенная часть среды, при разложении углеводов с образованием CO2 в среде также появляются газовые пузырьки или разрыв столбика;
при образовании H2S наблюдается почернение по ходу укола.
|
| Жидкие или полужидкие моноуглеводные среды Гисса; содержат один из углеводов, индикатор рН (табл. 5); рН среды устанавливают 7,2±0,2. Для выявления газообразования в жидкие среды вносят поплавок.
| При разложении углеводов образуются кислые продукты, снижающие рН среды, в результате чего индикатор рН изменяет цвет. Газообразование на жидких средах приводит к накоплению газа в поплавке, в полужидких – появлению разрывов или газовых пузырьков в среде.
|
| Продукция ацетил-метил-карбинола
| Выявляют с помощью реакции Фогес-Проскауэра, используют 10% КОН или 20% КОН.
| После добавления к культуре равного объёма 10% или 20% КОН и инкубации 4-24 часа при 370С в случае образования ацетилметилкарбинола среда окрашивается в розовый цвет с жёлтым оттенком; в случае образования ацетоина и 2,3-бутиленгликоля окраска не изменяется.
|
| ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
|
| Протеазы и пептидазы
| 5% обезжиренное молоко.
| Происходит свёртывание с образованием сгустков казеина и пептонизация с лизис казеина, при которой молоко становится прозрачным. Обе реакции могут происходить последовательно или одновременно.
|
| Свёрнутая сыворотка.
| Происходит разжижение.
|
| Столбик желатина.
| Происходит разжижение (желатину разжижают Proteus vulgaris, Bacillus anthracis).
|
| Молочный агар в чашках Петри имеет мутно-белый цвет.
| Появляются зоны просветления вокруг колоний на фоне мутно-белой среды.
|
| Дезами-назы амино-кислот
| Среда с одной из аминокислот и индикатором рН;
рН среды 7,2±0,2.
| Образуется аммиак, приводящий к защелачиванию среды и изменению цвета индикатора.
|
| Декар-боксилазы
| Среда с одной из основных аминокислот (аргинином, лизином, орнитином, гистидином, тирозином, глутамином) и индикатором рН.
| При наличии декарбоксилазной активности среда подщелачивается за счёт образования диаминов, вызывая изменение цвета индикатора.
|
| Трипто-фаназа
| Мясо-пептонный бульон или среда с аминокислотой триптофаном, а также индикаторная бумажка, смоченная щавелевой кислотой и закреплённая под пробкой над питательной средой.
| Образуется индол, который приводит к покраснению бумажки, смоченной щавелевой кислотой.
|
| Десуль-фуразы (цисти-назы)
| Среды с цистеином, метионином и качественным реактивом на H2S – солями железа, свинца, висмута.
| Образуется H2S, который взаимодействует с Fe2+(Pb2+, Vi2+) с образованием сульфида железа черного цвета, что вызывает почернение среды.
|
| Уреаза
| Среда с мочевиной и индикатором рН - феноловым красным, рН среды устанавливают 6,8±0,2.
| Образуется аммиак и окраска среды из красно-оранжевой переходит в малиново-лиловую за счёт сдвига рН в щелочную сторону.
|
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
|
| Липаза
| Желточный агар или среда с твином-80.
| Липазы гидролизуют жиры на глицерин и свободные жирные кислоты. Вокруг колоний в проходящем свете на поверхности среды видна радужная пленка (похожа на бензиновую пленку на поверхности воды).
|
| Лецити-наза
| Желточный агар (к 300 мл стерильного МПА, расплавленного и охлажденного до 45-500С, добавляют источник лецитина - желток куриного яйца).
| Лецитиназа расщепляет лецитин на фосфохолин и диглицерид, и вокруг колоний появляются опалесцирующие зоны, или «венчики помутнения»; лецитиназа есть у Staphylococcus aureus, клостридий, фузобактерий.
|
| ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ (ОВФ)
|
| Оксидаза
| Фильтровальная бумага, смоченная свежеприготовленным 1% раствором тетраметилпарафенилен-диамина (реактив на оксидазу).
| При нанесении бакпетлей 18-24 часовой культуры на поверхность фильтровальной бумаги в течение 1 мин появляется пурпурно-фиолетовое окрашивание; используют для дифференциации Pseudomonas spр. (оксидазопозитивные) и энтеробактерий (оксидазонегативные).
|
| Каталаза
| 3% раствор Н2О2; присутствие каталазы определяют у микроорганизмов, выращенных на любой питательной среде, кроме кровяных сред.
| При нанесении на колонию перекиси водорода, либо при внесении культуры в каплю перекиси на предметном стекле появляются пузырьки газа; используют для дифференциации Streptococcus spр. (каталазопозитивные) и Staphylococcus spp. (каталазонегативные).
|
| Дегид-разы
| Сахарный полужидкий агар (донор водорода) с 1% метиленовым синим (акцептор водорода).
| Дегидразы способны восстанавливать некоторые органические красители, поэтому метиленовый синий обесцвечивается. Используют для определения бактериальной обсеменённости молока: подкрасив молоко метиленовой синькой, определяют время его обесцвечивания. Чем оно меньше, тем более обсеменено молоко. Качественное молоко долго остаётся синим.
|
| Перокси-даза
| Используют бензидиновый тест: на предметное стекло наносят 4-6 капель суточной бактериальной культуры добавляют по 1-3 капли 2 % раствора метилпарааминофенол сульфата и 3% раствора Н2О2.
| В течение 5 – 10 мин бесцветная среда приобретает розовую или вишнёво-красную окраску. Положительная реакция характерна для Staphylococcus spp., отрицательная - Pseudomonas spp., Escherichia spp.
|
| ФЕМЕНТЫ-ТОКСИНЫ
|
| Гемо-лизины
| 5-10% кровяной агар.
| a-гемолизины приводят к неполному гемолизу с образованием вокруг колоний зоны неполного просветления среды, которая в течение 2-5 суток приобретает зеленовато-бурый оттенок.
b-гемолизины вызывают полный гемолиз с образованием прозрачной зоны вокруг колоний.
g-гемолизины не дают видимого глазом гемолиза.
|
| О-стрепто-лизин
| В пробирки с двукратными разведениями b-гемолитических стрептококков добавляют равный объем 5% эритроцитов кролика, инкубируют при 370С 1 час; параллельно ставят контроль из взвеси эритроцитов в питательном бульоне.
| В положительных случаях происходит гемолиз (лаковая кровь), в отрицательных случаях образуется осадок из эритроцитов.
Определяют титр О-стрептолизина - наибольшее разведение микробной культуры при котором наблюдается гемолиз.
|
| Плазмо-коагулаза
| Стерильная цитратная плазма крови, разлитая по 0,4 мл в пробирки.
| После внесения суточной агаровой культуры и инкубации посевов 2-5 часов при 370С происходит свёртывание плазмы и утрата ею текучести.
|
| Гиалуро-нидаза
| Побирка с гиалуроновой кислотой и уксусная кислота; при добавлении к гиалуроновой кислоте уксусной кислоты образуется сгусток муцина.
| Если тест-культура образует гиалуронидазу, то после 15 мин инкубации культуры бактерий при 370С в пробирке с гиалуроновой кислотой и добавления 2-3 капель уксусной кислоты образуется сгусток муцина.
|
| Нуклеазы
| МПА с ДНК, среда опалесцирует (полупрозрачна).
| Через 18-24 часа культивирования на среде после нанесения на ее поверхность 0,1% H2SO4 из-за деполимеризации ДНК и РНК вокруг колоний образуется прозрачный ореол - «венчик просветления».
|
| Фибри-
нолизин
| Сгустки фибрина.
| Растворение сгустков фибрина.
|
| Цито-токсины
| Культура эпителиальных клеток или др. и токсин, выделенный путем фильтрования культуральной жидкости с использованием бактериальных фильтров.
| При культивировании культуры клеток с безмикробным фильтратом токсина культура клеток утрачивает типичную тканевую морфологию: округляется, ядра пикнотизируются.
|
| Летучие жирные кислоты
| Газо-жидкостная хроматография кислото-эфирного экстракта ЛЖК из биологического материала или культуральной жидкости, содержащей анаэробы.
| На хроматограмме появляются пики в зависимости от массы и полярности вещества: чем легче вещество, тем раньше появляется пик на хроматограмме, поэтому ЛЖК выходят в следующей последовательности: уксусная, пропионовая, масляная, валериановая, капроновая (рис. 25). Изомасляная, изовалериановая, изокапроновая кислоты выходят раньше соответствующей кислоты.
|
| | | | | |
В последние годы в бактериологических лабораториях применяются одноразовые коммерческие тест-системы для биохимической идентификации. Они представляют собой пластиковые планшеты с лунками, заполненными дегидратированными субстратами с индикатором рН. Тест-системы позволяют изучать 20, 32, 64 биохимических признака (рис. 26).
1) выделение чистой культуры или изолированных колоний на плотной питательной среде;
2) приготовление бактериальной суспензии с определенной концентрацией микроорганизмов, которую определяют путем сравнения со стандартами мутности;
4) инкубация в термостате от 4 до 24 часов (длительность зависит от тест-системы) при 370С;
б) автоматическим с использованием микробиологического анализатора.
6) анализ результатов с использованием компьютерного банка данных, включающего биохимические профили разных видов микроорганизмов. Результаты ферментации учитываются по принципу +/- и вносятся в референс-таблицу, после чего происходит сравнение с компьютерным банком данных. Идентифицируемый микроорганизм относят к тому виду, с которым он проявляет наибольшее сходство и указывают степень сходства (в %). Хорошей идентификацией считается идентификация с 95% (и более) совпадением признаков.




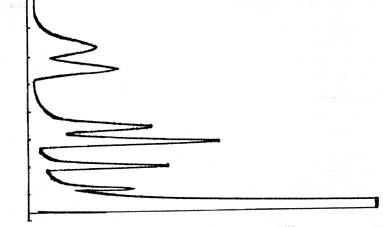 Рис. 25. Хроматограмма выхода ЛЖК, отражающая зависимость времени выхода стандартного раствора смеси летучих жирных кислот от их молекулярной массы и полярности (чувствительность электрометра 1 10 – 9)
Рис. 25. Хроматограмма выхода ЛЖК, отражающая зависимость времени выхода стандартного раствора смеси летучих жирных кислот от их молекулярной массы и полярности (чувствительность электрометра 1 10 – 9)
 внесение суспензии микроорганизмов в лунки тест-системы;
внесение суспензии микроорганизмов в лунки тест-системы;


