
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тонкая структура гелиеподобных атомовСодержание книги
Поиск на нашем сайте
Точность, с которой вычислены энергии термов в таблице 5.10, недостаточна для расчета тонкой структуры. Прежде чем перейти к более точному расчету, покажем на примере атома гелия, что изложенная выше теория хорошо описывает и сложные атомы. Во втором стационарном состоянии электрон, движущийся по третьей круговой орбите, имеет z
Подставив известные величины, находим z2=1,032852818. Электрон, движущийся по четвёртой эллиптической орбите, имеет z
находим z2=1,032846666.Таким образом, если в водородоподобных атомах для электронов, движущихся по любой орбите, z имеет одно и то же значение, то в гелиеподобных и в других более сложных атомах z зависит от формы и размеров орбиты. При излучении волны гелиеподобным атомом изменяется полная энергия не только у наружного электрона, но и внутреннего. Точно так же при переходе электрона с эллиптической орбиты на круговую изменится энергия у обоих электронов. Разности энергий термов, приведенных в таблице 5.11, можно определить по формуле
где Е1 и Е2 – полные энергии внутреннего и наружного электронов при нахождении последнего на круговой орбите; Е Теоретически рассчитать ЕТ трудно. Справочные данные не позволяют выявить закономерность изменения эффективных зарядовых чисел электронов в зависимости от их стационарного состояния и заряда ядра. Отличие энергий термов тонкой структуры наблюдается после пятой значащей цифры. Как показано выше, последние цифры значений термов получены расчетным способом и поэтому не могут быть использованы при создании новой теории. В таблице 5.11 для перехода 3/Д2 - 33Д2 в ионе лития и для переходов 23Р1 - 23Р0 и 33Р1 –33Р0 в ионе водорода приведены ориентировочные значения разностей термов. В настоящее время принято считать, что имеются две разновидности гелия: парагелий и ортогелий. Спины электронов в атоме гелия могут быть ориентированы или параллельно, или антипараллельно. У парагелия спины электронов ориентированы антипараллельно. Полный спиновый момент атома S=0. Внутреннее квантовое число при данном значении орбитального квантового числа L будет иметь лишь одно значение J=L. По этой причине все термы у парагелия будут синглетными. У ортогелия спины электронов ориентированы параллельно. Полный спиновый момент S=I. Внутреннее квантовое число при данном значении L будет иметь три значения: (L+1);L; (L-1). У ортогелия при L ³ 1 термы будут триплетными, а при L = 0 – синглетными. Отсутствие спина у электронов [76] ставит под сомнение целесообразность введения правила отбора и деления атомов гелия на две разновидности. На рис.5.5 все уровни энергий гелия изображены на одной схеме. С левой стороны схемы написаны символы, принятые в настоящее время для обозначения уровней энергий, а с правой – значения k и n согласно новой теории. Пунктирной линией показан уровень энергии для случая, если бы наружный электрон, находясь в первом стационарном состоянии, двигался по второй возможной круговой орбите.
Рис. 5.5. Схема уровней энергий в атоме гелия
Правилом отбора запрещены переходы между синглетными и триплетными уровнями по спиновому моменту. Однако, если рассматривать только три стационарных состояния, то можно насчитать как минимум пять таких переходов, наблюдаемых на опыте:23P0-11S0; 23P1-11S0 ; 33P0-11S0; 33P1-11S0 и 33P1-21S1. Многие авторы пытаются не замечать этого. Желая обосновать разделение атомов гелия на две разновидности и показать непротиворечивость правила отбора, одни из них утверждают, что переходы между уровнями энергий парагелия и ортогелия в экспериментах никогда не наблюдались [65,77], другие говорят, что в виде исключения возможен один переход 23P1-1'S0 [53,78], третьи показывают на схемах термов два перехода [73]. Анализируя схему на рис. 5.5, замечаем, что самопроизвольные переходы происходят не между всеми уровнями энергий. Есть уровни энергий, например 2/S0; 23 S1, переход с которых на более низкий уровень происходит только при соударении атомов. Их называют метастабильными. Таким уровням энергий могут соответствовать только круговые орбиты электронов. На основании вышеизложенного можно сделать следующие выводы: 1. Существующая и новая теории одинаково хорошо описывают тонкую структуру спектров, но при вычислении абсолютных значений термов получаются небольшие расхождения. 2. Существующая теория, объясняя тонкую структуру с помощью гипотезы о спине, предсказывает значительно большее количество уровней энергий, чем их наблюдается на самом деле в спектрах. Правило отбора было введено для устранения этого противоречия. 3. У гелиеподобных атомов при одном и том же стационарном состоянии электрона в зависимости от размеров орбиты и скорости электрона изменяется зарядовое число Z/. Вследствие этого у гелиеподобных атомов, в отличие от водородоподобных, в одном стационарном состоянии возможна не одна круговая орбита, а несколько. 4. Анализ спектра гелия с помощью новой теории приводит к выводу о нецелесообразности его разделения на два спектра: спектр парагелия и спектр ортогелия.
Магнитные эффекты в атомах
Согласно квантовой механике орбитальный механический момент электрона равен [64, 65] где l - орбитальное квантовое число; В невозбужденном атоме водорода электрон находится в S – состоянии. Его пространственное распределение сферически симметрично. Он как бы находится в “размазанном” состоянии по всему объему атома, радиус которого равен радиусу первой боровской орбиты. К такому выводу пришли на основе решения уравнения Шредингера и применения принципа неопределенности Гейзенберга. У электрона в S – состоянии l=0, поэтому и орбитальный механический момент согласно вышеприведенной формуле равен нулю. Магнитный момент также должен быть равен нулю, но опыт Штерна и Герлаха показал, что атом водорода имеет магнитный момент, равный одному магнетону Бора. Отсюда вывод: электрон имеет собственный момент импульса, названный спином, и собственный магнитный момент [66,79]. История спина электрона такова. В 1920 году для объяснения дублетной природы спектров щелочных металлов Зоммерфельд ввел внутреннее квантовое число Весной 1925 года в Гамбурге была опубликована статья, в которой дана общая формулировка принципа запрета Паули. В этой статье Паули показал, что гипотеза Зоммерфельда о моменте импульса атомного остова находится в противоречии с оболочечной структурой многоэлектронных атомов. Он выдвинул новую гипотезу, согласно которой момент импульса S обусловлен дублетностью квантовых свойств самого электрона. При этом он не связывал свою точку зрения ни с какой кинематической моделью. Он подчеркивал, что дублетность свойств электрона не поддается классическому описанию. Фактически для описания состояний электрона Паули формально ввел новое квантовое число [66,80]. В сентябре 1925 года, изучая вышеназванную статью, Уленбек и Гаудсмит пришли к выводу, что момент импульса электрона обусловлен его вращением вокруг собственной оси. С этого времени момент импульса электрона стал называться спином. Введение гипотезы о спине электрона разрешило все затруднения, имевшиеся в то время в спектроскопии. В 1928 году Дирак показал, что существование спина у электрона автоматически вытекает из релятивистского квантовомеханического уравнения для электрона, полученного им ранее. Так спин прочно вошел в квантовую механику [80,81]. Принято считать, что наличие спина у электрона экспериментально доказывается опытами Штерна и Герлаха. Однако такая интерпретация этих опытов неверна. В пучке атомов, пропускаемых между полюсами электромагнита, векторы орбитальных магнитных моментов ориентированы произвольно. Неоднородное поле оказывает двоякое действие на атомы. Оно вызывает прецессию атомов и одновременно отклоняет их в направлении, перпендикулярном направлению их движения. Векторы орбитальных магнитных моментов будут совершать круговые движения вокруг направления вектора магнитного поля. Одна половина атомов, у которых векторы орбитальных магнитных моментов образуют с вектором магнитного поля углы от 0 до 900, будет совершать прецессионное движение против часовой стрелки, если смотреть с конца вектора магнитного поля. Другая половина атомов, у которых магнитные векторы образуют с направлением магнитного поля углы от 90 до 1800, будет прецессировать в противоположную сторону. В неоднородном магнитном поле обе половины атомов должны отклониться на одну и ту же величину, но в разные стороны. Таким образом, эти эксперименты не дают оснований для заключения о наличии спина у электрона. В настоящее время опыт Штерна и Герлаха объясняется следующим образом. Согласно формуле (146) в таких атомах, как водород, орбитальный момент электрона в нормальном состоянии равен нулю. Такие атомы не должны были бы испытывать воздействие со стороны неоднородного магнитного поля, так как и орбитальный магнитный момент электрона у них также должен быть равен нулю. В опыте, однако, наблюдается расщепление пучка атомов водорода. Пришлось сделать допущение, что электрон обладает собственным магнитным моментом и собственным механическим моментом. Это допущение следует признать ошибочным. У электрона, движущегося по орбите, орбитальный момент не может быть равен нулю. Формула (146) неверна. Квантование орбитального момента происходит по закону L = n где n = 1, 2, …, k – орбитальное число, k – номер стационарного состояния. Таким образом, расщепление пучка атомов водорода в неоднородном магнитном поле обусловлено не спином электрона, а орбитальным моментом электрона. В невозбужденном атоме водорода электрон движется по круговой боровской орбите со скоростью МВ= где Произведем анализ формулы (147). Магнитный момент, создаваемый движущимся по боровской орбите электроном, равен [53] МВ = Si = где S – площадь контура с током; i – сила тока. Период обращения электрона Т=2 Подставляя найденное значение i в формулу (148), получим МВ= Если в формуле (147) вместо h подставить его значение согласно формуле (99), то она преобразуется к виду МВ= Сравнивая формулы (150) и (149), видим, что значение магнетона Бора, согласно формуле (149), в 1,000544617 раз меньше ныне принятого. По аналогии с постоянной Планка магнетон Бора должен быть равен сумме орбитальных магнитных моментов электрона и протона в атоме водорода: МВ= С учетом равенств МВ= Подставив известные величины, находим точное значение МВ=9,2689701×10-24 Дж/Тл. Формулу (149) можно вывести еще и другим способом. Предположим, что заряд электрона равномерно распределен по круговой орбите. Тогда линейная плотность заряда будет равна
Элемент длины окружности dl будет создавать магнитный момент относительно оси Y, перпендикулярной направлению поля, равный dM = где Весь контур будет создавать магнитный момент М= Таким образом, орбитальный магнитный момент равен М = Точная формула магнетона Бора с учетом магнитного момента ядра будет иметь вид МВ = где Согласно этой формуле магнетон Бора МВ будет равен 18,5379403×10-24 Дж/Тл.
Рис. 5.6. Схема для расчета орбитального магнитного момента
Если орбитальный магнитный момент электрона определить по формуле (151), то гиромагнитное отношение будет равно
а если по формуле (152), то
Эксперимент показал, что гиромагнитное отношение равно Если плоскость орбит электрона и протона в атоме водорода перпендикулярна направлению внешнего магнитного поля, то силы, действующие на электрон и протон, будут направлены в одну и ту же сторону. В зависимости от направления поля эти силы или увеличат, или уменьшат скорости вращения электрона и протона относительно центра масс [55]. Для атома водорода в магнитном поле должно быть справедливо следующее равенство:
где Выразив
С учетом этого уравнение (153) примет вид
где Для невозбужденного атома водорода можно записать
Отсюда находим
Теперь уравнение (154) примет вид
Это уравнение выражает зависимость между
или
Из уравнений (155) и (156) можно получить также следующие уравнения:
где Выведем формулы для расчета энергетических параметров электронов и протонов в атомах. Умножив правую и левую части уравнения (153) на
Если электрон движется по круговой орбите, то величина
Аналогично можно получить выражение для интеграла энергии протона
Просуммировав почленно последние два уравнения и принимая во внимание равенства
получим выражения для полной энергии системы “электрон-протон”
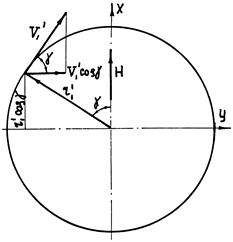
Первое уравнение позволяет вычислить полную энергию системы «электрон-протон» с помощью величин, характеризующих движение электрона, а второе – с помощью величин, характеризующих движение протона. Рассмотрим теперь общий случай, когда плоскость орбит электрона расположена под произвольным углом a к направлению магнитного поля (рис. 5.7). При расчетах удобнее вести отсчет углов от положительного направления оси X. До наложения магнитного поля угол между осью X и плоскостью орбит был равен j. При наложении магнитного поля плоскость орбит отклонится на угол d от первоначального положения. При этом угол между осью X и плоскостью орбит станет равным a. Сила Лоренца оказывает двоякое влияние на движение электрона и протона. Составляющая силы, направленная по радиусу-вектору, изменит скорость вращения электрона и радиус орбиты, а составляющая силы, направленная перпендикулярно радиусу-вектору, будет вызывать прецессию орбиты вокруг оси ОА/.
Рис. 5.7. Атом водорода в магнитном поле
В общем случае интеграл энергии имеет вид
где Индекс «1» опускаем, так как в дальнейшем расчеты будем производить с помощью величин, характеризующих движение электрона. Интеграл энергии описывает влияние на движение электрона только радиальной составляющей силы. Формулы (155), (156), (157) и (158) примут соответственно вид
Определив по формуле (162) скорость
Энергия системы, обусловленная действием силы
где E = 21,78687544·10-19Дж – полная энергия системы “электрон-протон” в невозбужденном состоянии. Формула (162) дает два значения скорости:
где Так как
то, следовательно,
Перпендикулярная составляющая силы Лоренца также сообщает системе “электрон-протон” дополнительную энергию. Движение электрона вызывает гироскопический момент относительно ядра
а движение протона вызывает гироскопический момент относительно электрона
Полный гироскопический момент будет равен
При уменьшении угла наклона орбиты на
Эта работа изменит энергию системы “электрон-протон”. При уменьшении угла наклона орбиты от угла
Сравнивая последнюю формулу с формулой (166), можно прийти к выводу, что более точное выражение для Еt будет иметь вид
При
Суммарное приращение энергии будет равно
На рис. 5.8 показана зависимость
Рис. 5.8. Зависимость Er, Et, и E
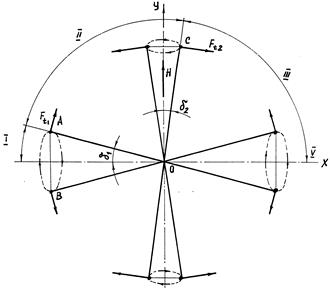
В газообразном водороде орбиты электронов ориентированы произвольно. На рис. 5.9 показано, как будет происходить переориентация орбит электронов в магнитном поле. В секторе I орбиты электронов отклоняются на угол
Подставляя значения известных величин, находим d1=2,2341094o.
Рис. 5.9. Ориентация орбит электронов в магнитном поле
Орбиты электронов, расположенные в секторе II, будут прецессировать вокруг мгновенной оси вращения и одновременно поворачиваться по часовой стрелке до момента совмещения оси вращения с осью Y. Когда угол между плоскостью орбиты и осью Y станет равным d2, момент силы Лоренца уравновесится гироскопическим моментом. Электромагнитное излучение может перевести орбиты электронов из положения А в положение С. При этом будет затрачена энергия, равная hn. Подставляя значение n=19750, находим Et=130,86499×10-25 Дж. Для этого случая формула (167) примет вид
Подставляя значения известных величин, находим d2=0,078866040. Орбиты электронов, находящиеся в секторе III, также будут прецессировать и одновременно поворачиваться по часовой стрелке. Когда плоскости орбит совместятся с осью X, прецессия прекратится. Для орбит, находящихся в положениях А и С, выполняется равенство
Отсюда находим
Если угол a выразить через угол d, то тогда получим для орбит, находящихся в положении А,
а для орбит, находящихся в положении С,
Подставляя численные значения величин, находим Полная энергия системы «электрон-ядро» равна
При движении электронов по круговым орбитам
Подставляя значения
где k – номер стационарного состояния; ν – частота обращения электрона вокруг ядра. Частота волн, излучаемых атомами, с высокой точностью определяется по формуле [69]
где En и Em – полные энергии системы “электрон-ядро” в начальном и конечном стационарных состояниях. С учетом формулы (170) можно записать
Для примера вычислим частоту излученной волны при переходе электрона со второго стационарного состояния в первое:
что соответствует длине волны 121,56683 нм. Таким образом, частота излученной волны не совпадает ни с частотой обращения электрона вокруг ядра в первом стационарном состоянии, ни с частотой обращения его во втором состоянии и даже не равна их разности. Аналогично и при магнитных резонансах частóты поглощаемых волн не совпадают с частотами прецессий орбит вокруг осей X и Y. Резонансная частота обусловлена только величиной поглощаемой энергии. Между резонансными частотами, магнитными моментами и частотами прецессий наблюдаются следующие соотношения:
Мы рассмотрели поведение орбит электронов в магнитном поле при положительных значениях угла В настоящее время методом магнитного резонанса определяются точные значения магнитных моментов ядер и электронов. Считается, что резонанс должен возникать при совпадении частоты проходящих электромагнитных волн с частотой Лармора [81,86]
Энергия контура с током в магнитном поле для случая, когда его плоскость параллельна направлению поля, равна
Определив по формуле
где J – спин электрона или ядра. Умножив правую и левую части этой формулы на 2
Точно такое же выражение получим и для частоты прецессии орбиты электрона, если учесть, что спина у электрона нет, а орбитальный магнитный момент выражается не формулой (150), а формулой (152). Следовательно, формула (171) неверна. По существующей теории энергия взаимодействия магнитного момента электрона с внешним магнитным полем выражается формулой [85,87]
а энергия взаимодействия магнитного момента ядра формулой [81,87]
В атоме водорода спин ядра равен ½, и поэтому последнее выражение для ядра приобретает вид, подобный формуле (174) для электрона, то есть
При напряженности магнитного поля H=70472930 А/м наблюдается резонансное поглощение энергии электромагнитных волн с частотами 30,006 МГц и 19750 МГц. Пользуясь формулами (173), (174) и (175), получим значения магнитных моментов для электрона Ме =9,2847701∙10-24 Дж/Тл и для протона Мр=1,4106076 Дж/Тл. Найденные экспериментально значения магнитных моментов не совпадают с теоретическими. Согласно формуле (150) МВ=9,2740154∙10-24Дж/Тл, то есть в 1,0011597 раз меньше Ме. Еще более запутанная ситуация с магнитным моментом протона. Ядерный магнетон определяется по формуле [88]
где m2 – масса протона. Если вместо
В таком виде трудно понять, что это выражение описывает. Согласно эксперименту значение Mp в 2,7928474 раза больше Mя. Изложенная выше теория устраняет все эти противоречия. Электроны и протоны не имеют спинов и собственных магнитных моментов. Ядерный магнитный и электронный парамагнитный резонансы обусловлены не прецессией вращающихся ядер и электронов, а прецессией орбит электронов. В настоящее время прецессию орбит электронов вокруг осей, параллельных направлению магнитного поля, принимают за прецессию электронов, а прецессию орбит электронов вокруг осей, перпендикулярных направлению магнитного поля, принимают за прецессию ядра.
Многоэлектронные атомы
Для расчета многоэлектронных атомов используется уравнение Шредингера. Это уравнение является аксиоматическим. Его нельзя вывести из основных законов. Оно само является основным законом [21]. В основу теории Шредингера положена гипотеза де Бройля о волновых свойствах частиц материи. Каждая движущаяся частица материи связана с волной, распространяющейся со скоростью, большей скорости света [89]. Значение этой скорости можно определить по формуле Движение частицы определяется законами распространения группы волн [91]. Групповая скорость волн V представляет собой скорость движения частицы. Скорость распространения отдельной синусоидальной волны называется волновой или фазовой скоростью. Фазовая скорость всегда больше скорости света. Чем меньше скорость частицы, тем больше фазовая скорость, и в пределе, когда скорость частицы V стремится к нулю, фазовая W стремится к бесконечности. Считается, что это не противоречит теории относительности, так как фазовая волна не несет энергию. Эти странные волны де Бройля не имеют наглядного физического представления [21]. Парадокс легко устраняется, если сделать разграничение между энергией частицы и энергией эфира. Энергия электрона на любой круговой орбите в атоме выражается формулой (104). Для удаления электрона из атома потребуется фотон с энергией
Из этого равенства находим
Скорость излученной волны будет равна
В этих формулах буквой m обозначена масса электрона, а буквой V/ – его скорость. Соответствующие формулы для фотонов выглядят следующим образом:
где mф – масса фотона. Формулу E = mC2 впервые получил Под m он понимал массу возмущенного эфира. Позднее Эйнштейн распространил этот закон и на весомую материю [62,90]. Постоянную Планка также можно выразить или через величины, относящиеся к электрону, или через величины, относящиеся к фотону. Формулу (99) можно записать в таком виде:
где m, V, r, Второе выражение для постоянной Планка получим из соотношения
Фотон не является частицей в обычном смысле этого слова. Частица имеет свою собственную массу. Фотон же является спиралевидной волной, распространяющейся в эфире. Он не имеет массы. Для удобства условно под массой фотона будем п
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.01 с.) |
||||||||||||||||||||||

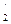 =1,03286015 (см. табл.5.3). Зарядовое число z для этого электрона можно определить по формуле
=1,03286015 (см. табл.5.3). Зарядовое число z для этого электрона можно определить по формуле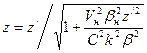 .
.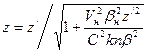
 ,
,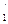 и Е
и Е  - Е2 = 0,416 см-1.
- Е2 = 0,416 см-1.
 , (146)
, (146) , h – постоянная Планка.
, h – постоянная Планка.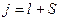 , где l - орбитальное квантовое число, S- момент импульса атомного остова. Расщепление уровня энергии на два подуровня означает, что момент импульса S имеет две ориентации по отношению к выделенному направлению в пространстве. Записав правила пространственного квантования в виде 2S+1=2, Зоммерфельд нашел значение S=1/2 [80].
, где l - орбитальное квантовое число, S- момент импульса атомного остова. Расщепление уровня энергии на два подуровня означает, что момент импульса S имеет две ориентации по отношению к выделенному направлению в пространстве. Записав правила пространственного квантования в виде 2S+1=2, Зоммерфельд нашел значение S=1/2 [80]. ,
,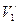 =2,186500611×106 м×с-1. Радиус орбиты
=2,186500611×106 м×с-1. Радиус орбиты 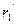 =0,529177249×10-11 м. Он создает магнитный момент, равный одному магнетону Бора МВ. Направление магнитного момента противоположно орбитальному механическому моменту. Величину магнетона Бора определяют по формуле [82]
=0,529177249×10-11 м. Он создает магнитный момент, равный одному магнетону Бора МВ. Направление магнитного момента противоположно орбитальному механическому моменту. Величину магнетона Бора определяют по формуле [82]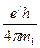 =9,2740154×10-24 Дж/Тл, (147)
=9,2740154×10-24 Дж/Тл, (147) =1,60217733×10-19 Кл – заряд электрона; h=6,6260755×10-34 Дж×с – постоянная Планка; m1=9,1093897×10-31 кг – масса электрона.
=1,60217733×10-19 Кл – заряд электрона; h=6,6260755×10-34 Дж×с – постоянная Планка; m1=9,1093897×10-31 кг – масса электрона. , (148)
, (148)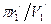 , следовательно, i=
, следовательно, i=  .
.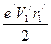 . (149)
. (149)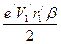 . (150)
. (150)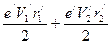 .
. и
и 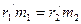 получим
получим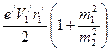 . (151)
. (151)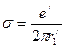 .
.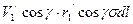 ,
,
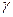 - угол между направлением поля и радиусом – вектором (рис. 5.6).
- угол между направлением поля и радиусом – вектором (рис. 5.6).
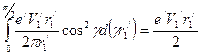 .
.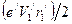 только в том случае, когда заряд электрона равномерно распределен по орбите. В атоме водорода заряд электрона сосредоточен практически в точке. Поэтому орбитальный магнитный момент электрона, находящегося на первой боровской орбите должен выражаться формулой, аналогичной формуле для орбитального механического момента тела, масса которого сосредоточена в одной точке, то есть
только в том случае, когда заряд электрона равномерно распределен по орбите. В атоме водорода заряд электрона сосредоточен практически в точке. Поэтому орбитальный магнитный момент электрона, находящегося на первой боровской орбите должен выражаться формулой, аналогичной формуле для орбитального механического момента тела, масса которого сосредоточена в одной точке, то есть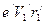 .
.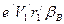 , (152)
, (152)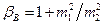 .
.
 ,
, .
.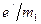 [65,83]. Следовательно, из двух формул (151) и (152) следует признать правильной формулу (152).
[65,83]. Следовательно, из двух формул (151) и (152) следует признать правильной формулу (152).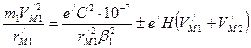 , (153)
, (153)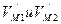 - орбитальные скорости электрона и протона атома водорода в магнитном поле;
- орбитальные скорости электрона и протона атома водорода в магнитном поле;  - радиус орбиты электрона в магнитном поле.
- радиус орбиты электрона в магнитном поле.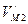 через
через 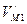 , получим
, получим .
. , (154)
, (154)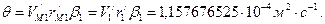

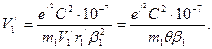

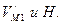 Решив его, находим
Решив его, находим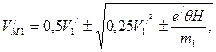 (155)
(155)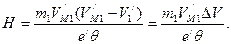 (156)
(156) (157)
(157) , (158)
, (158)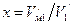 .
. получим
получим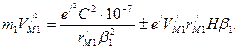 (159)
(159)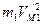 по модулю равна его потенциальной энергии, а величина
по модулю равна его потенциальной энергии, а величина 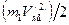 - его полной энергии. Следовательно, правая часть уравнения (159) равна по модулю потенциальной энергии электрона. Поделив оба слагаемых правой части уравнения (159) на два, получим абсолютную величину полной энергии электрона. Теперь можно написать интеграл энергии для электрона, движущегося по круговой орбите:
- его полной энергии. Следовательно, правая часть уравнения (159) равна по модулю потенциальной энергии электрона. Поделив оба слагаемых правой части уравнения (159) на два, получим абсолютную величину полной энергии электрона. Теперь можно написать интеграл энергии для электрона, движущегося по круговой орбите:

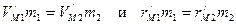 ,
, , (160)
, (160) .
.
 , (161)
, (161)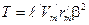 .
. ; (162)
; (162) ; (163)
; (163) ; (164)
; (164)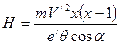 . (165)
. (165)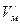 , можно найти полную энергию системы “электрон-протон”, находящейся в возбужденном состоянии:
, можно найти полную энергию системы “электрон-протон”, находящейся в возбужденном состоянии: .
. , равна
, равна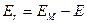 ,
, - орбитальная скорость электрона при наличии магнитного поля и
- орбитальная скорость электрона при наличии магнитного поля и  - переносная скорость электрона. Преобразовав формулу (163), получим выражение для гироскопического момента [84]
- переносная скорость электрона. Преобразовав формулу (163), получим выражение для гироскопического момента [84] ,
,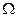 - угловая скорость электрона;
- угловая скорость электрона; 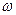 - переносная угловая скорость электрона; I – момент инерции.
- переносная угловая скорость электрона; I – момент инерции.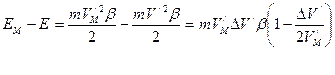 ,
,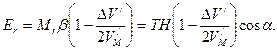 (166)
(166)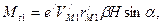


 будет совершена работа
будет совершена работа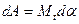 .
. до
до  энергия изменится на величину
энергия изменится на величину
 (167)
(167)
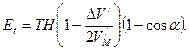 (168)
(168) 
 и
и  от угла наклона орбиты
от угла наклона орбиты  . При расчетах значение
. При расчетах значение  было принято равным 0,70472930 А/м [85]. Величина Еr изменяется от +130,78438×10-25 до -130,78438×10-25 Дж, величина Еt – от 0 до +261,56877×10-25 Дж, величина Е
было принято равным 0,70472930 А/м [85]. Величина Еr изменяется от +130,78438×10-25 до -130,78438×10-25 Дж, величина Еt – от 0 до +261,56877×10-25 Дж, величина Е  =+130,78438×10-25 Дж.
=+130,78438×10-25 Дж.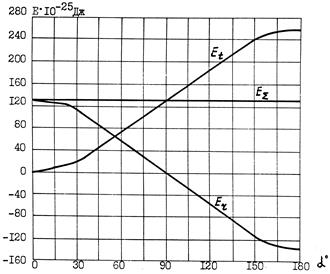
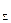 от угла наклона орбиты
от угла наклона орбиты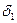 и будут прецессировать вокруг оси Х. Прецессия не позволяет орбитам отклониться на угол, больший
и будут прецессировать вокруг оси Х. Прецессия не позволяет орбитам отклониться на угол, больший  . Напряженности магнитного поля Н=0,70472930А/м соответствует резонансная частота n=30,008 МГц [85], а поглощаемая энергия Et=0,19882202×10-25Дж. Угол d1, при котором момент, создаваемый силой Лоренца, уравновешивается гироскопическим моментом, можно определить по формуле (168)
. Напряженности магнитного поля Н=0,70472930А/м соответствует резонансная частота n=30,008 МГц [85], а поглощаемая энергия Et=0,19882202×10-25Дж. Угол d1, при котором момент, создаваемый силой Лоренца, уравновешивается гироскопическим моментом, можно определить по формуле (168)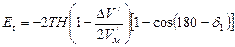 .
.
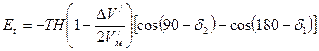 .
.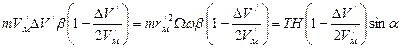 .
.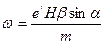 .
. ,
, .
.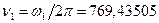 МГц,
МГц, 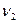 =19737,848 МГц.
=19737,848 МГц.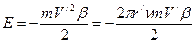 . (169)
. (169)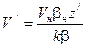 ;
;  .
.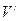 и
и  в уравнение (169), получим
в уравнение (169), получим , (170)
, (170)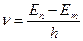 ,
,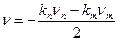 .
. ,
,
 . (171)
. (171) . (172)
. (172) энергию, поглощаемую электроном или ядром, можно с помощью формулы (172) вычислить магнитный момент. Однако для электронов и ядер резонансная частота определяется не по формуле (171), а по формуле [81,87]:
энергию, поглощаемую электроном или ядром, можно с помощью формулы (172) вычислить магнитный момент. Однако для электронов и ядер резонансная частота определяется не по формуле (171), а по формуле [81,87]: , (173)
, (173)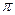 и подставив значения M и h согласно формулам (150) и (99), получим для электрона
и подставив значения M и h согласно формулам (150) и (99), получим для электрона .
. , (174)
, (174) . (175)
. (175) .
.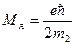 ,
,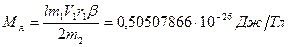 .
.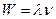 . Согласно де Бройлю
. Согласно де Бройлю  . Из равенств
. Из равенств 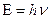 и
и 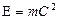 [90] находим
[90] находим 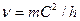 . Таким образом, скорость волны де Бройля
. Таким образом, скорость волны де Бройля 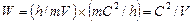 . В приведенных формулах буквами m и V обозначены соответственно масса и скорость частицы.
. В приведенных формулах буквами m и V обозначены соответственно масса и скорость частицы. . (176)
. (176)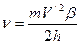 ;
;  . (177)
. (177)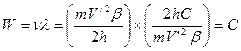 .
.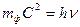 ;
; 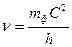 ;
; 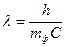 ; (178)
; (178) 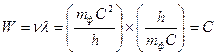 ,
, ,
,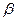 - величины, характеризующие движение электронов сложных атомов в первом стационарном состоянии.
- величины, характеризующие движение электронов сложных атомов в первом стационарном состоянии.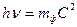 :
: . (179)
. (179)


