
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атомов и атомные спектрыСодержание книги
Поиск на нашем сайте
Основой современной атомной физики является квантовая механика [62]. Квантовые закономерности строения атомов были открыты Бором. Бор создал теорию, которая хорошо описывала строение атома водорода и закономерности в его спектрах. Дальнейшее развитие его теория получила в работах Зоммерфельда [63]. Эти учёные строго обосновали резерфордовскую планетарную модель атома. Однако вследствие трудностей, возникших при объяснении тонкой структуры спектров и строения сложных атомов, их теория была отвергнута. В последнее время вклад Бора и Зоммерфельда в развитие атомной физики недооценивается. Одни называют их теорию полуклассической [64], другие – черновым вариантом новой механики атома [65], третьи – лишь переходным этапом к созданию последовательной теории атома [66]. Некоторые авторы при изложении теории атома даже не называют их имён [62] или упоминают о них вскользь [64]. Творцами истинной теории атомов считаются Шредингер и Гейзенберг. В настоящее время атомы описываются очень сложным трёхмерным дифференциальным уравнением Шредингера [65]. В основе этого уравнения лежит гипотеза де Бройля, согласно которой электрон в атоме является одновременно и частицей и волной. Поскольку сам факт отождествления частицы с волной является абсурдным, противоестественным, то, следовательно, уравнение Шредингера не может адекватно описывать реальные процессы, происходящие в атомах. Ему неоправданно придается слишком большое значение в квантовой механике. Возможности уравнения Шредингера красноречиво характеризуются нижеприведенными выдержками из различных источников: 1. «Решения уравнения Шредингера для атома водорода не удается выразить через элементарные математические функции. Поэтому эти решения будут охарактеризованы в основном качественно. Для атомов, имеющих два и более электрона, точное решение уравнения Шредингера вообще не может быть получено в аналитическом виде» [62]. 2. «Уравнение Шредингера для атомов, содержащих более одного электрона, практически не может быть решено даже численным методом» [67]. 3. «Чтобы рассчитать спектральные термы даже атомов средних размеров, например железа, методом Хартри-Фока, потребовались бы годы работы электронно-вычислительных машин» [42]. 4. «Т. Киношита (Корнеллский университет, США) говорил, что для повышения точности расчетов ему приходилось заставлять работать большую ЭВМ в течение сотен часов». [68]. В атомной физике большая роль отводится принципу неопределенности Гейзенберга. В атомах с помощью уравнения Шредингера можно вычислить уровни энергий электронов и вероятность их нахождения в различных точках атома в заданный момент времени, а с помощью принципа неопределенности обосновать неточность таких расчетов. Однако этот принцип следует считать не только ошибочным, но и антинаучным. Он, с одной стороны, устанавливает предел познания в микромире, а с другой, – оправдывает наше незнание истинного строения микромира. Согласно принципу неопределенности нельзя вводить понятие траектории электрона в атоме, так как невозможно одновременно точно определить координаты и скорость электрона в атоме. В атоме водорода электрон, находящийся в основном стационарном состоянии, может оказаться в любой точке объема шара радиуса r=5,29·10-11м [69, 70], то есть он закону Кулона не подчиняется. Мы, как будет показано ниже, можем рассчитывать с высочайшей точностью все параметры любой орбиты электрона в атоме водорода и в том числе в любой момент времени можем определить с той же точностью одновременно координаты электрона и его скорость. Выполненные нами расчеты доказывают ошибочность принципа неопределенности. Теория Шредингера – Гейзенберга намного сложнее теории Бора – Зоммерфельда, а с её помощью решены только те задачи, которые уже были решены Бором и Зоммерфельдом. Приняв на вооружение их теорию, физикам пришлось отказаться от образного мышления и принципа непротиворечивости здравому смыслу. Принято считать, что с помощью уравнения Шредингера объясняется причина квантования уровней энергии в атомах, но о какой достоверности такого объяснения может идти речь, если при выводе этого уравнения было сделано нелепое допущение, что электрон является волной. Наша теория является логическим продолжением теории Бора-Зоммерфельда. При ее создании использовался обширный экспериментальный материал, связанный с определением значений ионизационных потенциалов и энергий термов оптических и рентгеновских лучей. В справочной литературе значения ионизационных потенциалов и энергий термов приводятся с очень высокой точностью, достигающей восьми-, десятизначащих цифр. Эти данные надежны, так как получены в результате обобщения экспериментального материала, которым располагает все человечество. Результаты теоретических исследований с помощью методик, разработанных на основе нашей теории, хорошо согласуются с вышеназванными экспериментальными данными. Новая теория создана на основе ньютоновских представлений о пространстве и времени. Одним из важнейших ее достоинств является возможность наглядно представить строение атомов и получить ряд новых интерпретаций процессов, происходящих в атомах. Нами получены точные формулы, описывающие движение взаимодействующих тел. Так называемые релятивистские эффекты, наблюдаемые при движении взаимодействующих тел со скоростями, близкими к скорости света, мы учитываем с помощью формул эффекта движения. Согласно теории относительности движение вызывает увеличение массы тел. С нашей точки зрения, движение вызывает изменение эффективности взаимодействия между телами. При встречном движении тел эффективность взаимодействия между ними усиливается, а при удалении их друг от друга, наоборот, – ослабляется. Нами разработана методика расчета параметров орбит сложных атомов по известным значениям ионизационных потенциалов и выведены формулы, позволяющие теоретически рассчитывать значения ионизационных потенциалов у многоэлектронных атомов. Таким образом, можно теоретически рассчитать любой сложный атом, что свидетельствует о неограниченных возможностях классической физики.
Апробация новой теории
Новая теория очень проста и доступна для понимания любому, кто захочет познать тайны атома. В то же время она позволяет решать с высокой точностью любые задачи в атомной физике. Покажем это вначале на примере физических констант. Некоторые константы, которые ранее были определены экспериментально, можно точно вычислить по формулам [71]. В качестве исходных данных возьмём значения четырёх констант [28]: скорость света
Таблица 5.1 Физические константы
Полная энергия системы “электрон-протон” в атоме водорода согласно уравнениям (61) равна
Для электрона в системе единиц СИ С учетом этого ионизационный потенциал атома водорода будет равен
Индекс Н будем ставить у величин, характеризующих движение электрона по первой боровской орбите в атоме водорода. Формулы (88) и (96) позволяют получить новое выражение для ионизационного потенциала водорода:
откуда находим скорость электрона на первой боровской орбите
Бор показал, что в атомах электроны могут двигаться только по таким орбитам, для которых выполняется условие [69]
где Таким образом, постоянная Планка равна произведению 2
Точное значение
где Принимая во внимание, что
Постоянную Планка можно выразить через величины, характеризующие движение электрона по первой боровской орбите: Неизменяемой величиной, имеющей одно и то же значение у всех атомов, будет также
Потенциал ионизации атома водорода можно выразить через постоянную Планка и частоту излучаемой волны
где Приравняв правые части уравнений (98) и (100) и подставив вместо
Если бы ядро было неподвижно, то постоянная Ридберга имела бы следующее значение:
Для описания тонкой структуры спектров Зоммерфельд ввёл новую постоянную [65]
Это выражение можно упростить. Из уравнений (97) и (98) находим
Подставляя в формулу (102) значения
Период обращения электрона по первой боровской орбите можно вычислить по формуле
Атом водорода
Параметры орбит электронов в атомах можно выразить через параметры боровской орбиты [72]. Полную энергию системы «электрон-атом» при движении электронов по круговым орбитам можно определить или по формуле
где z/ - эффективное зарядовое число ядра, или по формуле
Ввиду того, что в дальнейшем мы будем иметь дело только с величинами, относящимися к электронам, индекс 1 у букв ставить не будем. С учетом равенства
Формулу (98) можно записать в следующем виде:
Приравняв правые части уравнений (103) и (106), можно записать
В атоме водорода эффективное зарядовое число z без учета эффекта движения равно единице, поэтому для боровской орбиты формула (107) примет вид
Таким образом, для электронов, движущихся по круговым орбитам, в любом атоме выполняются равенства
Отсюда находим
Формулу (103) преобразуем к виду
Приравняв правые части уравнений (104) и (109), находим
Для боровской орбиты
поэтому уравнение (110) можно записать в виде
Отсюда найдем
При движении электрона по эллиптической орбите полная энергия выражается уравнениями
Преобразуем формулу (113) к виду
где n – орбитальное число, характеризующее степень вытянутости орбиты. Приравняв правые части уравнений (113) и (115), находим
Принимая во внимание, что
из последнего уравнения получим
Эти формулы можно записать и в таком виде:
где Совместное решение уравнений (116), (117) и (118) позволяет получить следующие соотношения:
Умножив и разделив правую часть уравнения (113) на произведение
Приравняв правые части уравнений (114) и (122) с учетом формулы (111), получим
Аналогично находим
Из этих уравнений следует
Выразив ra, rn и l через rн, получим
Полную энергию системы «электрон-атом» можно выразить через полную энергию боровского атома. Подставив в формулу (114) значения
Теперь выразим период обращения любого электрона вокруг ядра через период обращения электрона в боровском атоме. Для этого в формулу (94) подставим значение m согласно формуле (86). Получим выражение
Выразив l через rн, а Va и Vn через Vн, получим
Для электрона в боровском атоме согласно этой формуле
И, таким образом, для электронов в любом атоме
С учетом формулы (125) формулу (127) можно представить еще и в таком виде:
Приступим к расчету параметров орбит электрона в атоме водорода. С помощью формулы (75¢) находим Vн=2,186442460×106 м×с-1; rн=5,291913231×10-11 м; Eн=21,78571660×10-19Дж; Тн=1,520738462×10-16с. Вследствие эффекта движения значения величин
Ввиду равенства левых частей уравнений (97) и (130), правые их части также будут равны и, следовательно,
но так как
Подставляя значения величин, находим е=1,602156024 Кл. В таблице 5.2 приведены параметры орбит электрона в атоме водорода для четырёх стационарных состояний. Расчет производился в такой последовательности. По формуле (112) определяли скорости электрона при движении по круговым орбитам. Для атома водорода она примет вид
По формулам (123) и (124) определяли скорости электрона в перицентре и в апоцентре при движении по эллиптической орбите. Для атома водорода они имеют вид
В таблице приведены истинные значения скоростей электрона, то есть с учетом эффекта движения. Для круговых орбит мы находим их по формуле (76/), а для эллиптических – по формулам
Таблица 5.2
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.008 с.) |

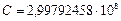 м/c; элементарный заряд
м/c; элементарный заряд 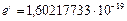 Кл; масса электрона
Кл; масса электрона 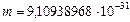 кг; боровский радиус
кг; боровский радиус 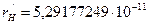 м. В таблице 5.1 приведены для сравнения вычисленные и справочные значения констант. Ниже даётся вывод формул, по которым производился расчёт.
м. В таблице 5.1 приведены для сравнения вычисленные и справочные значения констант. Ниже даётся вывод формул, по которым производился расчёт. эВ
эВ
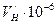 , м/c
, м/c

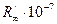 , м-1
, м-1 
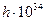 , Дж×с
, Дж×с
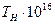 , с
, с
 . (96)
. (96)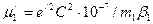 .
.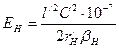 . (97)
. (97)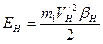 , (98)
, (98)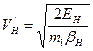 .
.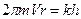 ,
, - номер стационарного состояния;
- номер стационарного состояния;  - постоянная Планка.
- постоянная Планка.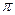 на момент количества движения электрона, находящегося в первом стационарном состоянии. Согласно последнему уравнению можно записать
на момент количества движения электрона, находящегося в первом стационарном состоянии. Согласно последнему уравнению можно записать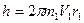 .
. ,
, - масса ядра;
- масса ядра;  - скорость ядра;
- скорость ядра;  - радиус орбиты ядра.
- радиус орбиты ядра.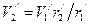 и
и 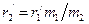 , окончательно получим
, окончательно получим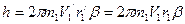 .
. . (99)
. (99) .
. :
: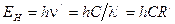 , (100)
, (100) - длина волны,
- длина волны,  - постоянная Ридберга.
- постоянная Ридберга. .
.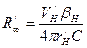 . (101)
. (101)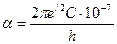 . (102)
. (102) .
. и
и 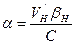 .
.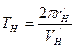 .
.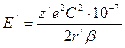 , (103)
, (103) 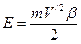 . (104)
. (104)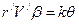 (105)
(105)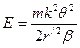 . (106)
. (106)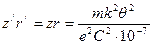 . (107)
. (107)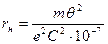 .
. .
. ;
;  . (108)
. (108)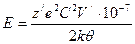 . (109)
. (109)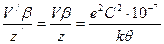 . (110)
. (110) , (111)
, (111)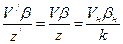 .
.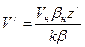 ;
; 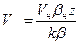 . (112)
. (112) ; (113)
; (113) . (114)
. (114)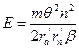 , (115)
, (115) .
. ;
; 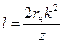 , (116)
, (116) ;
; 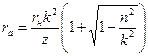 ; (117)
; (117) ;
;  . (118)
. (118)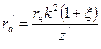 ;
;  ; (119)
; (119)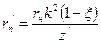 ;
;  , (120)
, (120)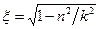 - эксцентриситет эллипса.
- эксцентриситет эллипса. ;
;  . (121)
. (121)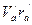 , запишем его в следующем виде:
, запишем его в следующем виде: . (122)
. (122)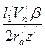 =
=  =
=  .
.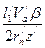 =
=  =
= 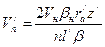 ;
; 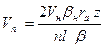 ;
; ;
; 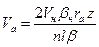 .
. ;
; 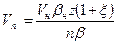 ; (123)
; (123) ;
; 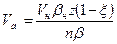 . (124)
. (124)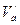 и
и  согласно формулам (123) и (124), получим
согласно формулам (123) и (124), получим =
=  . (125)
. (125) . (126)
. (126) . (127)
. (127)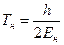 .
.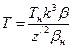 . (128)
. (128) . (129)
. (129)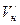 и
и  увеличиваются, а значения величин
увеличиваются, а значения величин  и
и 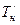 уменьшаются. При расче-
уменьшаются. При расче-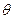 =1,157676525×10-4 м2×с-1. В формуле (97) заряд электрона e/=1.60217733×10-19Кл. При этом полагают, что его величина не зависит от скорости движения электрона. Но это допущение сделано ошибочно. Формуле (97) следует придать вид, подобный формуле (103):
=1,157676525×10-4 м2×с-1. В формуле (97) заряд электрона e/=1.60217733×10-19Кл. При этом полагают, что его величина не зависит от скорости движения электрона. Но это допущение сделано ошибочно. Формуле (97) следует придать вид, подобный формуле (103): . (130)
. (130)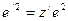 ,
, , а у водорода z = 1, то
, а у водорода z = 1, то .
.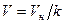 . (131)
. (131)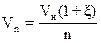 ; (132)
; (132) . (133)
. (133)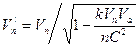 ;
;  .
.


