Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тонкая структура водородоподобных атомовСодержание книги
Поиск на нашем сайте
В таблице 5.8 приведены значения длин волн, вычисленные по новой методике, и значения длин волн, взятые из справочника [73]. Результаты расчетов по новой методике для переходов из второго стационарного состояния в первое с точностью до восьмой значащей цифры совпадают со справочными данными. Для переходов из третьего стационарного состояния в первое имеются небольшие расхождения. Еще большие расхождения наблюдаются для переходов из третьего стационарного состояния во второе.
Таблицы 5.8 Длины волн, излучаемых водородом
В таблице 5.9 приведены параметры орбит иона водорода Н-, полученные расчетным способом. Эффективные зарядовые числа для электронов в первом стационарном состоянии определялись так же, как и для атома гелия. Энергия связи электрона с ионом Н- была принята равной Е=1,20830
определялось эффективное зарядовое число для второго электрона. Для других орбит эффективные зарядовые числа определяли методом интерполяции. Далее все величины находили известным способом. Как видно из таблиц 5.3, 5.4, и 5.9, у всех гелиеподобных атомов в первом стационарном состоянии имеется одна круговая орбита, во втором - четыре круговых и одна эллиптическая, в третьем – пять круговых и две эллиптические. У водородоподобных атомов число возможных орбит электронов значительно меньше. В первом стационарном состоянии имеется одна орбита, во втором – одна круговая и одна эллиптическая, в третьем – одна круговая и две эллиптические. Число эллиптических орбит в каждом стационарном состоянии у гелиеподобных и водородоподобных атомов совпадает. Причина такого различия у атомов заключается в следующем. Электроны в атомах могут двигаться только по таким орбитам, для которых выполняется условие Одновременно для круговых и эллиптических орбит соответственно должны выполняться равенства
В одном стационарном состоянии возможны несколько орбит только в том случае, если не нарушается равенство (144). Равенство (145) показывает, что такое возможно при условии, если одновременно с изменением параметров орбит V/ и r/ будет изменяться и эффективное зарядовое число z/. У водородоподобных атомов зарядовое число изменяется только при изменении формы орбиты, которая характеризуется эксцентриситетом
Таблица 5.9 Параметры орбит электронов в ионе водорода Н-
Продолжение табл. 5.9
У гелиеподобных и других более сложных атомов зарядовое число изменяется не только при изменении формы орбиты, но и при изменении V/ и r/. Из выражений (114) и (125) находим для эллиптической орбиты
а для круговой
Из выражения (121) находим соответственно для эллиптической и круговой орбит
Как видим, зарядовое число пропорционально скорости электрона и обратно пропорционально размерам его орбиты. У всех атомов, кроме водородоподобных, в каждом стационарном состоянии возможны несколько орбит. При возбуждении атома, по мере перехода электрона на более удаленную орбиту данного стационарного состояния, зарядовое число уменьшается. Минимальное его значение равно целому числу. В гелиеподобных атомах В таблице 5.10 приведены энергии термов гелиеподобных атомов. Для атома гелия и для первых двух стационарных состояний наружного электрона в ионе лития данные взяты из справочника [73]. Энергии термов иона водорода и энергии термов иона лития, наружный электрон которого находится в третьем стационарном состоянии, вычислены по формуле Ет = Е1 + Е2 - Е10, где Е1 и Е2 – полные энергии соответственно внутреннего и наружного электронов при нахождении последнего в К-м стационарном состоянии. Их значения приведены в табл. 5.4 и 5.9, Е10 – полная энергия внутреннего электрона после удаления из атома наружного электрона. Для иона водорода
Таблица 5.10
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.008 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

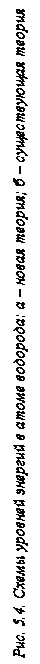

 . Для случаев, когда наружный электрон во втором стационарном состоянии двигался по пятой круговой орбите, а в третьем стационарном состоянии – по седьмой орбите, Хmax находили по формуле (138). Затем по формуле
. Для случаев, когда наружный электрон во втором стационарном состоянии двигался по пятой круговой орбите, а в третьем стационарном состоянии – по седьмой орбите, Хmax находили по формуле (138). Затем по формуле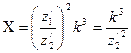
 . (144)
. (144)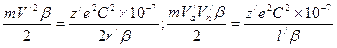 . (145)
. (145)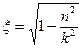 .
.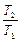
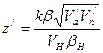 ,
, .
. .
.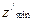 = N-1, в литиеподобных
= N-1, в литиеподобных 
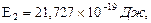 Т2/Т1=4, а для иона лития
Т2/Т1=4, а для иона лития  при
при 
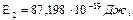 Т2/Т1=2,5.
Т2/Т1=2,5.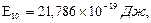 для иона лития
для иона лития