
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементы орбит электрона в атоме водородаСодержание книги
Поиск на нашем сайте
Продолжение табл. 5.2
Радиусы круговых орбит, перицентральные и апоцентральные радиусы эллиптических орбит можно определить по формуле
Эффективные зарядовые числа для электрона, движущегося по круговым орбитам, в атоме водорода определим по формуле
а при движении по эллиптическим орбитам по формуле
Длину большой оси эллипса можно вычислить по формуле (116), но проще по формуле
Длину малой оси находим по формуле
Полную энергию вычислим по формуле (125), которая для атома водорода примет вид
Для атома водорода формула (128) также упростится:
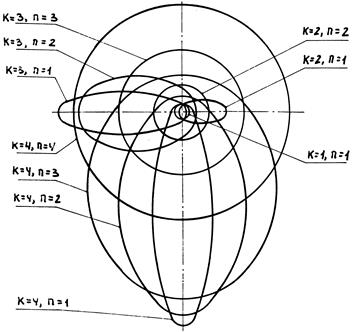
На основании проведенных расчетов можно сделать следующие выводы. Каждая орбита характеризуется только двумя квантовыми числами k и n. В атоме водорода зарядовое число z равно единице только для электрона, неподвижного относительно ядра. Для электронов, движущихся по орбитам, зарядовое число z/ больше единицы. У электронов, находящихся в одном стационарном состоянии, но движущихся по орбитам с разными значениями n, длины больших осей имеют разные значения и соответственно разные у них будут и полные энергии. В атоме водорода достаточно с высокой точностью экспериментально определить параметры первой боровской орбиты. Параметры остальных возможных орбит можно с той же точностью определить расчетом по вышеприведенным формулам. На рис. 5.1 изображены в масштабе возможные орбиты для четырех стационарных состояний электрона в атоме водорода.
Рис. 5.1. Орбиты электрона в атоме водорода
Атом гелия
Потенциал ионизации может быть выражен в джоулях, электронвольтах и в см-1. Уточним значения переводных множителей из см-1 в джоули и электронвольты. Потенциал ионизации водорода Е = 21,78687544×10-19 Дж = 13,59829218 эВ = 1,09677583×107 м-1. Отсюда находим 1 эв = 8,065540992×103 см-1; 1 Дж = 5,034112546×1022 см-1. Потенциал ионизации водорода, выраженный в волновых числах, можно определить по формуле
а выраженный в джоулях, - по формуле
Поделив правую часть первого уравнения на правую часть второго уравнения и приняв во внимание, что 1 Дж = Отсюда можно сделать вывод, что волновое число, соответствующее 1 Дж, не зависит от эффекта движения. В настоящее время при определении волнового числа, соответствующего 1 эВ, заряд электрона принят равным 1,60217733·10-19 Кл, т.е. с учетом эффекта движения. Результаты расчетов будут более точны, если волновое число, соответствующее 1 эВ, определять по формуле 1 эВ = где е=1,602156024 · 10-19 Кл. В этом случае 1 эВ=8,065433735 · 103 см-1. Теперь перейдем к расчету атома гелия. Скорость электрона на первой орбите положительного иона гелия находим по формуле (112) V = 4,374670768×106 м×с-1. С учетом эффекта движения
По формуле (125) находим ионизационный потенциал Е=87,19702679×10-19 Дж. При расчетах значение b для гелия было принято равным 1,000136117. Чтобы электрон в атоме гелия достиг оптического предела, требуется затратить энергию, равную 198310,76 см-1 [73] или 39,3933902×10-19 Дж. Энергетический баланс можно выразить следующим уравнением:
где V/1 и V/2 - скорости электронов на внутренней и наружной орбитах; V/1в - скорость электрона на внутренней орбите после удаления наружного электрона на последнюю из возможных орбит в атоме гелия. Выразив скорости электронов через Vн, последнее уравнение можно записать в виде
Многоэлектронный атом будет устойчив только в том случае, если периоды обращения электронов будут кратными периоду обращения электрона на самой нижней орбите. В атоме гелия период обращения наружного электрона Т2 в два раза больше периода обращения внутреннего электрона Т1. Формула (128) позволяет записать
Выразив z Отношение периода обращения наружного электрона во втором стационарном состоянии к периоду[AK1] обращения электрона на внутренней орбите равно
Приблизительное значение z
где Е - энергия, которая требуется для перевода наружного электрона из невозбужденного состояния в возбужденное. Подставляя в формулу (136) значения z
где Е =38454,691 см-1 =7,63882226×10-19Дж. Подставляя в последнее уравнение известные величины, находим z В таблице 5.3 приведены основные параметры орбит электронов в атоме гелия для трех стационарных состояний наружного электрона. Значения величин z/, l /, E, и Т были вычислены соответственно по формулам (137), (116), (125), и (128). Вычисленные значения rn, ra, Vn, Va, и b приведены в работе [72]. На рис. 5.2 изображены в масштабе орбиты электронов в атоме гелия. Таблица 5.3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.78.90 (0.01 с.) |

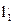 ×10-10, м
×10-10, м
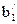 ×10-10, м
×10-10, м
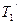 ×10-16, с
×10-16, с
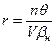 .
.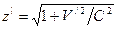 ,
,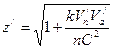 .
.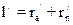 .
.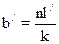 .
.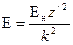 .
.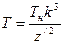 .
.
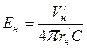 ,
,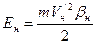 .
.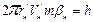 , получим
, получим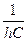 или 1 эВ =
или 1 эВ = 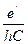 .
.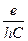 ,
, 4,375136606×106 м×с-1;
4,375136606×106 м×с-1;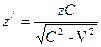 =2,000212970.
=2,000212970.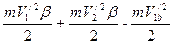 =39,3933902×10-19 Дж,
=39,3933902×10-19 Дж, =39,3933902·10-19 Дж. (134)
=39,3933902·10-19 Дж. (134)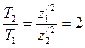 . (135)
. (135)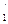 через z
через z 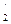 и подставив значения других известных величин в формулу (134), находим z
и подставив значения других известных величин в формулу (134), находим z 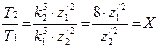 . (136)
. (136)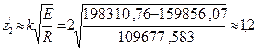 ,
,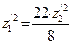 . Теперь формулу (134) можно записать в виде
. Теперь формулу (134) можно записать в виде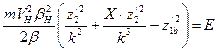 , (137)
, (137)


