Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамическая фаза. Фазовый переходСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
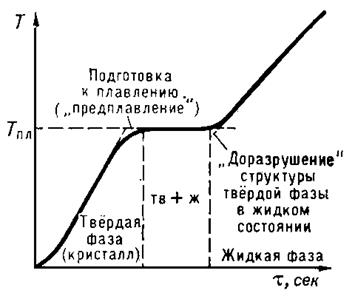
Термодинамическая фаза – термодинамически однородная по свойствам часть термодинамической системы, отделенная от других фаз поверхностями раздела, на которых скачком изменяются некоторые свойства системы1. В однокомпонентной системе разные фазы могут быть представлены различными агрегатными состояниями или разными полиморфными модификациями вещества. В многокомпонентной системе фазы могут иметь различный состав и структуру. Газ всегда состоит из одной фазы, жидкость может состоять из нескольких жидких фаз разного состава, но двух разных жидкостей одного состава в равновесии сосуществовать не может. Вещество в твердом состоянии может состоять из нескольких фаз, причем некоторые из них могут иметь одинаковый состав, но различную структуру (полиморфные модификации, аллотропия). Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств. Выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма. Набор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний, то есть одно и то же агрегатное состояние вещества может находиться в различных термодинамических фазах (лед, например, встречается в пяти различных модификациях — фазах). Именно поэтому описание вещества в терминах агрегатных состояний довольно огрублённое, и оно не может различить некоторые физические разные ситуации. В любом случае при наличии раздела фаз подразумевается принципиальная возможность перехода вещества из одной фазы в другую. Фазовый переход (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. Значение температуры, давления или какой-либо другой физической величины, при котором происходят фазовые переходы в однокомпонентной системе, называют точкой перехода. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую). Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход. Различают фазовые переходы двух родов. Фазовый переход первого рода (например, плавление, кристаллизация и т.д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Наиболее распространённые примеры фазовых переходов первого рода: плавление и кристаллизация, испарение и конденсация, сублимация и десублимация. Фазовые переходы первого рода характеризуются постоянством температуры, изменениями энтропии и объёма. Объяснение этому можно дать следующим образом. Под скачкообразным изменением свойств вещества имеется в виду скачок при изменении температуры и давления. В реальности же, воздействуя на систему, мы изменяем не эти величины, а её объем и её полную внутреннюю энергию. Это изменение всегда происходит с какой-то конечной скоростью, а значит, что для того, чтобы «покрыть» весь разрыв в плотности или удельной внутренней энергии, нам требуется некоторое конечное время. В течение этого времени фазовый переход происходит не сразу во всём объёме вещества, а постепенно. При этом в случае фазового перехода первого рода выделяется (или забирается) определённое количество энергии, которая называется скрытой теплотой фазового перехода. Для того, чтобы фазовый переход не останавливался, требуется непрерывно отводить (или подводить) это тепло, либо компенсировать его совершением работы над системой. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решётки. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. При подобных переходах – из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние – степень беспорядка увеличивается и, с точки зрения второго начала термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет. Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами второго рода. Эти переходы характеризуются постоянством объема и энтропии. При этом плотность и внутренняя энергия так же не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д. Общая трактовка фазовых переходов II рода предложена советским ученым Л. Д. Ландау (1908—1968). Согласно этой трактовке, фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Наиболее распространённые примеры фазовых переходов второго рода: прохождение системы через критическую точку, переход парамагнетик-ферромагнетик или парамагнетик - антиферромагнетик, переход металлов и сплавов в состояние сверхпроводимости, переход жидкого гелия в сверхтекучее состояние, переход аморфных материалов в стеклообразное состояние. Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода. В последнее время широкое распространение получило понятие квантовый фазовый переход, т.е. фазовый переход, управляемый не классическими тепловыми флуктуациями, а квантовыми, которые существуют даже при абсолютном нуле температур. Деление фазовых переходов на два рода несколько условно, так как бывают фазовые переходы первого рода с малыми скачками параметра порядка и малыми теплотами перехода при сильно развитых флуктуациях. Это наиболее характерно для переходов между жидкокристаллическими фазами. Плавление твердых тел Примером фазового перехода первого рода являются плавление и кристаллизация твердых тел. Процесс плавления играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.). Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое. Главными характеристиками плавления чистых веществ являются температура плавления (Т пл) и теплота (теплота плавления Q пл), которая необходима для осуществления процесса плавления. В процессе плавления температура кристалла остается постоянной. Эта температура и называется температурой плавления Тпл.. У каждого вещества своя температура плавления. Температура плавления для данного вещества зависит от атмосферного давления. Самую высокую температуру плавления среди чистых металлов имеет вольфрам (3410 °С), самую низкую – ртуть (–38,9 °С). Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура. Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании - увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в собственном расплаве. Плавление начинается при достижении кристаллическим веществом Т пл. С начала плавления до его завершения температура вещества остаётся постоянной и равной Т пл, несмотря на сообщение веществу теплоты (рис. 1). Нагреть кристалл до Т > Т пл в обычных условиях не удаётся, тогда как при кристаллизации сравнительно легко достигается значительное переохлаждение расплава. Плавление происходит с поглощением скрытой теплоты фазового перехода – теплоты плавления Qпл.. Удельная теплота плавления qпл. показывает, какое количество теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления: qпл. = Qпл./m, Дж/кг. Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления. Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.
Рис. 1. Остановка температуры при плавлении кристаллического тела. Согласно молекулярно-кинетическим представлениям, плавление осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др. В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Т пл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Q пл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает. С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится. У аморфных тел изменение температуры со временем не имеет участка с постоянной температурой, а только точку перегиба. Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости. Обратный переход вещества в твердое состояние возможен как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход осуществляется из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это относится к дальнему порядку, который имеет место в кристаллах и которого нет ни в жидкостях, ни в газах). Поэтому переход в твердое состояние должен происходить скачком при определенной температуре, в отличие от перехода жидкость–пар, который может происходить непрерывно. Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1403; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.176 (0.008 с.) |