
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реальные газы. Жидкости. Твердые тела. Фазовые переходы. Фазовая диаграмма.Содержание книги
Поиск на нашем сайте Ван дер Ваальс предположил, что на малых расстояниях (r) между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. На основе этих представлений, даже не рассматривая количественной зависимости межмолекулярного взаимодействия от расстояния, он получил так называемое Ван-дер-Ваальсово уравнение состояния реального газа.
Для одного моля газа Ван-дер-Ваальса оно имеет вид: V — объем, T — абсолютная температура, R — универсальная газовая постоянная, a - учитывает притяжение молекул, b — конечный объем молекулы. Свойства жидкостей Одним из характерных свойств жидкости является то, что она имеет определённый объём (при неизменных внешних условиях), но принимает форму сосуда, в котором находится. Жидкость чрезвычайно трудно сжать, поскольку давление равномерно передаётся по всей поверхности (принцип Паскаля). Эта особенность используется в гидравлических машинах. Другим свойством является диффузия. При нахождении в сосуде двух смешиваемых жидкостей молекулы начинают постепенно диффундировать через поверхность раздела, постепенно выравнивая концентрации обоих типов молекул. Кроме того, жидкости (как и газы) характеризуются вязкостью. Она определяется как способность частиц двигаться относительно друг друга. В поверхностном слое и вблизи поверхности жидкости действуют силы, которые обеспечивают существование поверхности и не позволяют молекулам покидать объем жидкости. Благодаря тепловому движению некоторая часть молекул имеет достаточно большие скорости, чтобы преодолеть силы, удерживающие молекулы в жидкости, и покинуть жидкость. Это явление называется испарением. Оно наблюдается при любой температуре, но его интенсивность возрастает с увеличением температуры. Таким образом, в случае неудаления молекул скорость испарения уменьшается со временем. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, будет равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным. Для определения силы поверхностного натяжения проведем опыт. Возьмем прямоугольную проволочную рамку, одна сторона которой l может перемещаться в вертикальной плоскости. Опустив рамку в мыльный раствор, а затем вытащив ее, получим пленку, натянутую на рамку. Эта пленка будет сокращать свою поверхность, и подвижная часть рамки начнет перемещаться из положения, указанного на рисунке 1 штрихованной линией. Измерить модуль результирующей силы поверхностного натяжения Fн можно, приложив к проволочке некоторую силу mg, уравновешивающую силу поверхностного натяжения и возвращающую подвижную проволочку в исходное положение.
Капиллярные явления и смачиваемость.
где р — плотность жидкости, g — ускорение свободного падения. Кристаллы (особенности кристаллических решеток, типы кристаллических решеток). Теплоемкость кристаллов. Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая. как показали рентгенографические исследования немецкого физика-теоретика М. Лауэ (1879—1960), является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех Измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — средние равновесие положения, около которых частицы совершают колебания, называются узлами кристаллической решетки. Кристаллические тела можно разделить па две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного типа может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связала с закономерным размещением частиц, образующих кристалл. Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы). Х Ионные кристаллы. В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (NаО, СsСl, КВr и т. д.), а также оксидов различных элементов (МgО, СаО и т. д.). Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями. Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электровоз в электронных оболочках атомов. Фазовые переходы первого рода — фазовые переходы, при которых скачком изменяются первые производные термодинамических потенциалов Примеры: Плавление — переход из твердого кристаллического состояния в жидкое. Фазовые переходы второго рода — фазовые переходы, при которых первые производные термодинамических потенциалов по давлению и температуре Примеры: § переход ферромагнитных веществ (железа, никеля) при определенных давлении в температуре в парамагнитное состояние, § переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля.
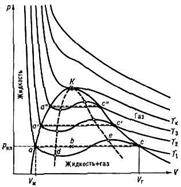
Фаза — термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза — вода; газообразная фаза — водяные пары. Агрегатное состояние вещества зависит от его давления
Точка, в которой пересекаются эти кривые, определяет температуру
|
||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 447; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

 Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объемом и температурой.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объемом и температурой.


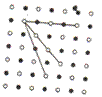 арактерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропии монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, во разные по направлению отрезки (рис. 2), т. с.
арактерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропии монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, во разные по направлению отрезки (рис. 2), т. с.  плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристалла вдоль этаж направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристаллов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направляем в среднем одинаковы.
плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристалла вдоль этаж направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристаллов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направляем в среднем одинаковы. по интенсивным параметрам системы (температуре или давлению). Переходы первого рода реализуются как при переходе системы из одного агрегатного состояния в другое, так и в пределах одного агрегатного состояния (в отличие от фазовых переходов второго рода, которые происходят только в пределах одного агрегатного состояния).(поглощение или выделение тепла)
по интенсивным параметрам системы (температуре или давлению). Переходы первого рода реализуются как при переходе системы из одного агрегатного состояния в другое, так и в пределах одного агрегатного состояния (в отличие от фазовых переходов второго рода, которые происходят только в пределах одного агрегатного состояния).(поглощение или выделение тепла) , где
, где  — удельная теплота фазового перехода
— удельная теплота фазового перехода  — количество тепла, поглощаемого или выделяемого при фазовом переходе 1 килограмма вещества,
— количество тепла, поглощаемого или выделяемого при фазовом переходе 1 килограмма вещества,  — масса вещества.
— масса вещества. и температуры
и температуры  . Кривые фазового равновесия на диаграмме состояния показывают значения давления и температуры, при которых возможно равновесие двух фаз.
. Кривые фазового равновесия на диаграмме состояния показывают значения давления и температуры, при которых возможно равновесие двух фаз.

 и давление
и давление  одновременного равновесного сосуществования трех фаз вещества. Эта точка называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды характеризуется температурой
одновременного равновесного сосуществования трех фаз вещества. Эта точка называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды характеризуется температурой  (
( ) и давлением
) и давлением  .
.


