
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение ионов в технологических растворах,Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Природных и сточных водах Методом прямой потенциометрии можно определять содержание в растворе многих катионов и анионов: H+, Na+, K+, Ca2+, Mg2+, Cu2+, Cl–, F–, CSN–, NO3–, S2– и других. Определение проводят методом ионометрии с использованием градуировочного графика.
Порядок выполнения работ 1. Подготовка рН-метра и электродов к работе; 2. Приготовление стандартных растворов определяемого иона; 3. Измерение потенциала в стандартных растворах; 4. Расчёт уравнения градуировочного графика, построение графика и установление электрохимических характеристик ИСЭ; 5. Измерение потенциала электрода в анализируемом растворе, набор статистических данных, для этого проводят 5-6 повторных измерений; 6. Определение концентрации определяемого иона; 7. Математическая обработка результатов.
Работа 1. Определение рН растворов Цель работы: Определении рН различных растворов методом прямой потенциометрии с использованием градуировочного графика Е = f (pH). Оценка правильности и воспроизводимости результатов определения.
Реактивы, посуда, приборы: Стандартный раствор кислоты НС1 0,500 М; Стандартный раствор хлорида калия КС1 0,500 М; Стандартный раствор янтарной кислоты С4Н6О4 0,500 М; Стандартный раствор тетрабората натрия Na2B4O7 0,250 M; Стандартный раствор уксусной кислоты CH3COOH 1,00 M; Стандартный раствор ацетата натрия CH3COONa 1,00 M; Стандартный раствор гидроксида натрия NaOH 1,00 M; Стандартный раствор борной кислоты H3BO3 0,200 M; Колбы мерные вместимостью 50,00 мл – 4 шт.; Стаканчики с размешивателями на 50 мл – 5 шт.; Иономер; Магнитная мешалка; Индикаторный электрод – стеклянный; Электрод сравнения – хлоридсеребряный. Выполнение работы
1. Определение значения рН раствора по индикаторной бумаге. Для определения рН раствора методом градуировочного графика необходимо предварительно выяснить приблизительную величину рН раствора, чтобы знать, какие буферные растворы необходимо приготовить для точных измерений. Для этого можно воспользоваться универсальной индикаторной бумагой, которая дает переход окраски при всех значениях рН. Определяют приблизительное значение рН анализируемого раствора и записывают в лабораторный журнал. 2. Приготовление буферных растворов. Определив приблизительное значение рН растворов, выбирают по таблице 2.1 четыре буферных раствора с такими значениями рН, чтобы два буферных раствора имели более кислую реакцию, а два – более щелочную реакцию по сравнению с анализируемым раствором. Готовят выбранные буферные растворы в мерных колбах вместимостью 50,00 мл. Для этого пипетками наливают необходимое число миллилитров каждого компонента буферного раствора согласно таблице 2.1, доводят объем буферного раствора в колбе до метки дистиллированной водой и тщательно перемешивают. 3. Построение градуировочного графика. В четыре сухих стаканчика помещают по одному размешивателю и наливают до половины стакана приготовленные буферные растворы. Стеклянный и хлоридсеребряный электроды погружают в буферный раствор с наименьшим значением рН на расстоянии 1 см от дна стакана. При постоянном перемешивании раствора через 1-2 мин. после установления равновесия измеряют потенциал стеклянного электрода (Е, мВ), следуя инструкции, приведенной в разделе 2.1.1. Каждый раз после измерения потенциала электроды споласкивают из промывалки дистиллированной водой и осушают полосками фильтровальной бумаги. Затем поочередно проводят измерения Е во всех приготовленных буферных растворах, переходя последовательно от низких значений рН к более высоким. Полученные результаты записывают в таблицу 2.2.
Таблица 2.2 – Результаты измерений потенциала в зависимости от рН
Таблица 2.1 – Таблица реактивов для приготовления 50,00 мл буферных растворов По полученным данным рассчитывают уравнение градуировочной зависимости y = а + bx и записывают в виде Е = а + b рН. Строят градуировочный график зависимости величины потенциала электрода в милливольтах от показателя концентрации иона водорода рН на миллиметровой бумаге в масштабе: 2 см - 50 мВ, 2 см – 1 ед. рН. Рекомендации по построению градуировочного графика указаны в разделе 1.1. По градуировочному графику определяют электрохимические характеристики стеклянного электрода: 1) область значений рН, для которой соблюдается прямолинейная зависимость, 2) угловой коэффициент градуировочного графика и сравнивают его с теоретическим значением. 4. Определение рН анализируемого раствора. В чистый сухой стаканчик наливают пробу раствора, рН которого надо определить. Опускают в него размешиватель, электродыи при постоянном перемешивании раствора после установления постоянного значения измеряют потенциал электрода в растворе. Измерения повторяют 5-6 раз, каждый раз заливая в стаканчик новую пробу воды. Результаты измерения записывают в таблицу 2.2. Затем по градуировочному графику по одной из измеренных величин потенциала графически определяют значение рН анализируемого раствора. По результатам каждого из измерений Е по уравнению градуировочного графика рассчитывают значения рН. 5. С целью оценки воспроизводимости и правильности результатов анализа проводят математическую обработку полученных результатов определения рН. Все данные представляют в виде таблицы 1.1 (см. раздел 1.3). Работа 2. Определение катионов и анионов в водах Цель работы: Определение содержания катионов или анионов в водах методом прямой потенциометрии с использованием градуировочного графика. Оценка правильности и воспроизводимости результатов определения.
Реактивы, посуда, приборы: Исходный стандартный раствор солей концентрации 0,1000 М или сухие соли; содержащие определяемый ион; Колбы мерные вместимостью 50,00 мл; Пипетка вместимостью 5,00 мл; Стаканчики с размешивателями на 50 мл; Иономер-рН-метр; Магнитная мешалка; Индикаторный электрод – ионоселективный к определяемому иону; Электрод сравнения – хлоридсеребряный.
Выполнение работы
1. Приготовление стандартных растворов соли Стандартные растворы меньшей концентрации готовят из исходного стандартного 0,1000 М раствора соли методом последовательного разбавления. Например, для приготовления раствора соли с концентрацией 1,000 . 10-2 моль/л 5,00 мл 0,1000 М раствора пипеткой переносят в мерную колбу вместимостью 50,00 мл, разбавляют дистиллированной водой до метки и хорошо перемешивают. Каждый последующий раствор концентрацией в десять раз меньше готовят из раствора концентрации в десять раз больше. Так растворы 10-3 моль/л готовят из раствора 10-2 моль/л, а раствор 10-4 моль/л – из раствора 10-3 моль/л и т.д. 2. Построение градуировочного графика В сухих стаканчики помещают по одному размешивателю и наливают до половины стакана исходный и приготовленные стандартные растворы. Соответствующий ионоселективный и хлоридсеребряный электроды погружают в раствор на расстоянии 1 см от дна стакана. При постоянном перемешивании раствора через 1-2 мин. после установления равновесия измеряют потенциал электрода (Е, мВ), следуя инструкции, приведенной в разделе 2.1. Измерения начинают со стандартного раствора наименьшей концентрации определяемого иона, последовательно переходя к наибольшей. Каждый раз после измерения потенциала электроды споласкивают из промывалки дистиллированной водой и осушают полосками фильтровальной бумаги. Полученные результаты записывают в таблицу 2.3. Измерения повторяют 2-3 раза.
Таблица 2.3 – Данные для построения градуировочного графика Е – рС
По полученным данным рассчитывают уравнение градуировочной зависимости вида у = а + b х и строят градуировочный график зависимости Е - рС на миллиметровой бумаге в масштабе: 2 см - 50 мВ, 2 см – 1 ед. рС. Построение градуировочного графика следует проводить по рекомендациям, указанным в разделе 1.1. По градуировочному графику определяют электрохимические характеристики ионоселективного электрода: 1) область значений рС, для которой соблюдается линейная зависимость, 2) угловой коэффициент градуировочного графика и сравнивают его с теоретическим значением. 3. Определение концентрации ионов в анализируемом растворе В чистый сухой стаканчик наливают пробу анализируемого раствора, опускают размешиватель, электродыи при постоянном перемешивании раствора после установления постоянного значения измеряют потенциал электрода в растворе. При необходимости разбавляют анализируемый раствор таким образом, чтобы значение потенциала в растворе после разбавления соответствовало приблизительно середине градуировочного графика. Измерения повторяют 5-6 раз, каждый раз заливая в стаканчик новую пробу воды. При разбавлении анализируемого раствора следует отобрать две пробы (V пр) анализируемого раствора, разбавить их в мерных колбах (V к) и провести три параллельных измерения для каждой колбы. Результаты измерения Е записывают в таблицу 2.4. Затем по градуировочному графику по одной из измеренных величин потенциала графически определяют значение рС анализируемого раствора. По результатам каждого из измерений Е, используя уравнение градуировочного графика рассчитывают значение рС. По величине рС высчитывают концентрацию в моль/л и мг/л. Все значения заносят в таблицу 2.4.
Таблица 2.4 – Результаты определения содержания ионов в воде
Пример расчета. По градуировочному графику или его уравнению найдено значение рХ = – lgХ = 3,34. Молярная концентрация иона в воде составит С (Х) = 10-рХ = 10-3,34 = 0,00045 моль/л. Концентрация иона в мг/л будет равна
СХ = С (Х) . М (Х) . 1000,
где М (Х) – молярная масса иона, г/моль. Если предварительно проводилось разбавление, то концентрация иона в анализируемом растворе составит
С = С Х
3. С целью оценки воспроизводимости и правильности результатов проводят математическую обработку результатов определения концентрации С, мг/л и данные представляют в виде таблицы 1.1(см. раздел 1.3).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 440; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.92.58 (0.009 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

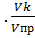 .
.


