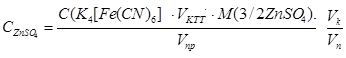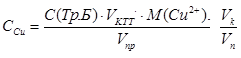Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Амперометрическое титрованиеСодержание книги
Поиск на нашем сайте
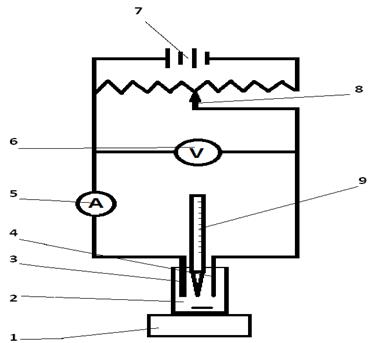
Метод амперометрического титрования основан на измерении силы предельного диффузионного тока в процессе титрования. По кривой зависимости ток I диф – объем титранта находят объем титранта в конечной точке титрования. Амперометрическое титрование возможно при использовании химических реакций, в ходе которых в растворе изменяется содержание полярографически активного компонента, а, следовательно, и предельный ток его электрохимического окисления или восстановления. Достаточно, чтобы один из участников химической реакции был электроактивным: определяемое вещество, титрант или продукт реакции. В амперометрическом титровании могут быть использованы реакции окисления-восстановления, комплексообразования, осаждения. Другим основным условием выполнения определения методом амперометрического титрования является правильный выбор потенциала электрода, который поддерживается постоянным при титровании. Перед выполнением амперометрического титрования необходимо снять вольтамперные зависимости для определяемого вещества, титранта и продуктов реакции, чтобы 1) установить, какой из компонентов является электроактивным, 2) выбрать потенциал титрования. Значение потенциала выбирают соответствующее площадке предельного диффузионного тока на вольтамперной кривой электроактивного компонента химической реакции, так как в этих условиях I диф. = к C. Форма кривых титрования зависит от того, какой из компонентов химической реакции будет электроактивным при потенциале титрования. Кривая состоит из двух линейных участков, точка пересечения которых соответствует точке эквивалентности. По ее положению определяют объем титранта, пошедший на реакцию с определяемым веществом Установка для амперометрического титрования При амперометрическом титровании используется принципиально та же установка, на которой снимают полярограммы постоянного тока. Рабочим (индикаторным) электродом служит микроплатиновый электрод или ртутный капающий электрод. В ячейку к анализируемому раствору добавляют фоновый электролит.
Рисунок 4.1 – Схема установки для амперометрического титрования: 1 – магнитная мешалка, 2 – ячейка с анализируемым раствором, 3 – рабочий электрод (микроплатиновый), 4 – электрод сравнения (хлоридсеребряный), 5 – микроамперметр, 6 – вольтметр, 7 – источник постоянного тока, 8 – делитель напряжения (реохорд), 9 – бюретка.
4.2. Исследование условий определения методом амперометрического титрования При определении методом амперометрического титрования используют более разбавленные растворы определяемого соединения и титранта чем при потенциометрическом титровании. Как правило, концентрация титранта не превышает ~ 0,01 моль/л. Для выполнения определения готовят титрант по точной навеске или приблизительной концентрации и устанавливают его концентрацию по установочному веществу. Выбор объема пробы анализируемого раствора на титрование проводят так же как при потенциометрическом титровании (см. раздел 2.2.2). Если известно, что концентрация определяемого компонента в анализируемом растворе выше концентрации титранта, то рассчитывают необходимую степень разбавления анализируемого раствора, при которой расход титранта не будет превышать 5 мл. Одним из основных условий амперометрического титрования является выбор потенциала, при постоянном значении которого проводят титрование. Как указано выше потенциал титрования выбирают по вольтамперной кривой электроактивного компонента реакции титрования из области потенциалов предельного диффузионного тока.
Определение металлов в технологических растворах и водах
Порядок выполнения работ 1. Подготовка к работе полярографа и электродов. 2. Снять вольтамперные кривые фонового электролита, титранта, раствора определяемого компонента. 3. Выбрать потенциал титрования и установить его постоянное значение на полярографе при проведении титрования. 4. Расчет объема пробы анализируемого раствора и разбавление пробы в мерной колбе (при необходимости). 5. Титрование анализируемого раствора, построение кривой титрования. 6. Расчет концентрации определяемого соединения. Работа 1. Определение концентрации ионов цинка в технологических растворах производства вискозного волокна Цель работы: Определение содержания ионов цинка в растворах методом амперометрического титрования.
Определение ионов цинка основано на использовании в качестве титранта раствора гексацианоферрата (ll) калия. При титровании протекает реакция: 3ZnSO4 + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2 + 3K2SO4.
Для установления конечной точки титрования (КТТ) используют амперометрический метод, основанный на измерении в процессе титрования предельного диффузионного тока электроактивного компонента реакции. В данном случае электроактивным является титрант, который окисляется на микроплатиновом аноде [Fe(CN)6] 4- – e- → [Fe(CN)6] 3-.
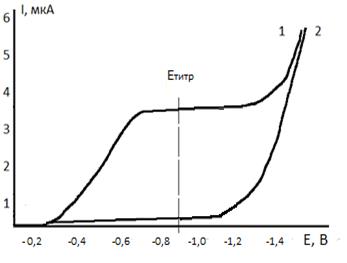
Основным условием амперометрического титрования является выбор потенциала при котором измеряют диффузионный ток. Для этого снимают вольтамперные кривые фонового электролита и компонентов реакции, которые представлены на рисунке 4.2.
Рисунок 4.2 – Вольтамперные кривые: 1 – титранта, 2 – определяемого компонента, продуктов реакции, фонового электролита
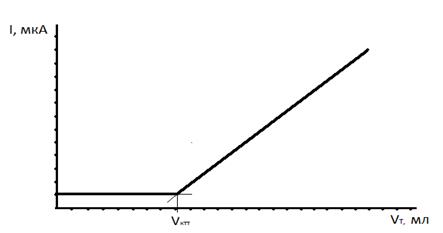
Кривая титрования ионов цинка раствором K4[Fe(CN)6] приведена на рисунке 4.3. Рост тока после достижения КТТ обусловлен увеличением в растворе концентрации электроактивного титранта K4[Fe(CN)6]. Задание 1. Кратко законспектировать теоретические основы метода, записать реакции, на которых основано определение, и зарисовать схему установки [1]. 2. Зарисовать вольтамперные кривые фона и компонентов реакции титрования, выбрать потенциал, при котором проводят титрование. Для снятия вольтамперных кривых в ячейку для титрования заливают 20 мл раствора фонового электролита (0,1 М раствор Na2SO4) и снимают вольтамперограмму. Затем в раствор фона прибавляют 1 мл титранта и снимают вольтамперограмму. 3. Записать методику определения ионов цинка, построить кривую титрования в координатах I, мкА от V, мл на миллиметровой бумаге и рассчитать концентрацию ионов цинка в растворе.
Рисунок 4.3 – Кривая амперометрического титрования Методика определения ионов цинка. В мерную колбу вместимостью V к, мл переносят V пр, мл анализируемого раствора и доводят раствор до метки дистиллированной водой. После перемешивания пипеткой V п, мл полученного раствора переносят в ячейку для титрования, добавляют 20,00 мл фонового электролита. На полярографе задают потенциал титрования E Т, выбранный по вольтамперной кривой электроактивного компонента. Перемешивают раствор и проводят титрование, прибавляя титрант с концентрацией С (K4[Fe(CN)6]) по 0,1 мл. Результаты титрования записывают в виде таблицы 4.1. По результатам титрования строят кривую титрования и находят V КТТ, мл.
Таблица 4.1 – Данные для построения кривой титрования
Концентрацию сульфата цинка в растворе рассчитывают по формуле:
где С (K 4 [ Fe (CN)6]) = …………… моль/л, V к = ……………………………………… мл, V пр = ……………………….. мл, V п = ……………………….. мл. Значения вышеприведенных величин для расчета концентрации студент получает при выполнении работы. Работа 2. Определение концентрации ионов меди в технологических растворах Цель работы: Определение содержания ионов меди в растворах методом амперометрического титрования.
Определение ионов меди основано на использовании в качестве титранта раствора двунатриевой соли этилендиаминтетрауксусной кислоты (трилон Б). При титровании протекает реакция комплексообразования:
Cu2+ + Na2H2Y → CuH2Y + 2Na+.
Для установления конечной точки титрования (КТТ) в процессе титрования измеряют предельный диффузионный ток, значение которого зависит от концентрации электроактивного компонента реакции. В данном случае электроактивным является определяемое вещество, которое восстанавливается на микроплатиновом катоде:
Cu2+ + e- → Cu+.
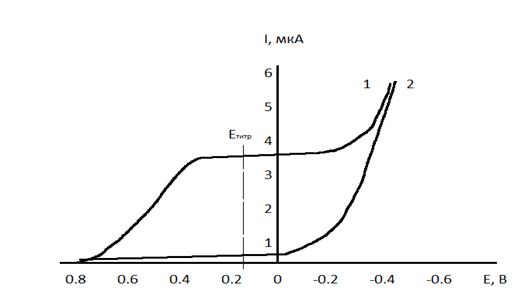
Основным условием амперометрического титрования является выбор потенциала, при котором измеряется диффузионный ток. Для этого снимают вольтамперные кривые фонового электролита и компонентов реакции, которые представлены на рисунке 4.4. В качестве фонового электролита используют аммиачный буфер с рН 9.
Рисунок 4.4 – Вольтамперные кривые: 1 – определяемого иона, 2 – фона, титранта, продуктов реакции
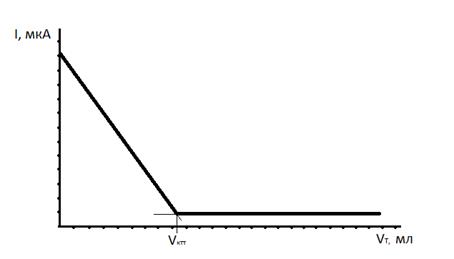
Кривая титрования ионов меди раствором трилона Б, показанная на рисунке 4.5, имеет вид:
Рисунок 4.5 – Кривая амперометрического титрования
Уменьшение силы тока с начала титрования обусловлено уменьшением в растворе концентрации ионов меди в процессе титрования. После КТТ ток остается незначительным (остаточный ток) и постоянным, так как в растворе нет электроактивных компонентов.
Задание 1. Кратко законспектировать теоретические основы метода, записать реакции, на которых основано определение, и зарисовать схему установки [1]. 2. Зарисовать вольтамперные кривые фона и компонентов реакции титрования, выбрать потенциал, при котором проводят титрование. Для снятия вольтамперных кривых в ячейку для титрования заливают 20 мл раствора фона и снимают вольтамперограмму. Затем в раствор фона прибавляют 1 мл определяемого иона и снимают вольтамперограмму. 3. Записать методику определения ионов меди, построить кривую титрования в координатах I, мкА от V, мл на миллиметровой бумаге и рассчитать концентрацию ионов цинка в растворе. Методика определения ионов меди. В мерную колбу вместимостью V к, мл переносят V пр, мл анализируемого раствора и доводят раствор до метки дистиллированной водой. После перемешивания пипеткой V п, мл полученного раствора переносят в ячейку для титрования, добавляют 20,00 мл фонового электролита. На полярографе задают потенциал титрования E Т, выбранный по вольтамперной кривой электроактивного компонента. Перемешивают раствор и проводят титрование, прибавляя титрант с концентрацией С (Трилон Б) по 0,1 мл. Результаты титрования приведены ниже в таблице 4.2. По результатам титрования строят кривую титрования и находят V КТТ, мл.
Таблица 4.2 – Данные для построения кривой титрования
Концентрацию ионов меди в растворе рассчитывают по формуле:
где С (Тр. Б) = …………… моль/л, V к = ……………………………… мл, V пр = ………………… мл, V п = ………………….. мл.
Значения вышеприведенных величин для расчета концентрации студент получает при выполнении работы. 4.4. Контрольные вопросы
1. На чем основан метод амперометрического титрования? 2. К какой группе методов относится метод амперометрического титрования? 3. Приведите схему установки для амперометрического титрования. 4. Какие электроды используют в этом методе? 5. С какой целью к анализируемому раствору добавляют фоновый электролит? 6. Зачем и на какой установке снимают вольтамперные кривые? 7. Укажите основные условия для определения методом амперометрического титрования. 8. Как выбирают потенциал титрования? 9. Укажите оси координат для кривой амперометрического титрования. 10. Как находят конечную точку титрования? 11. От чего зависит форма кривой титрования? 12. По какому закону рассчитывают концентрацию определяемого вещества по результатам титрования? Запишите его выражение. 13. Укажите последовательность выполнения анализа методом амперометрического титрования.
КУЛОНОМЕТРИЧЕСКИЕ МЕТОДЫ Кулонометрические методы анализа основаны на определении количества электричества, которое расходуется на электрохимическую реакцию. Различают два основных вида кулонометрии: прямая кулонометрия и кулонометрическое титрование. В прямой кулонометрии анализируемое вещество подвергается электрохимическому превращению в ячейке. При кулонометрическом титровании определяемое вещество реагирует с электрогенерированным титрантом, который получается в ячейке из вспомогательного реагента. В основе количественного определения веществ в кулонометрии лежит закон Фарадея, устанавливающий связь между количеством электропревращенного вещества и количеством израсходованного при этом электричества: m = MQ / nF, где m – масса электрохимически превращенного вещества, г; М – молярная масса вещества, г/моль; Q – количество электричества, Кл; n – число электронов, участвующих в электрохимической реакции; F – постоянная Фарадея, равная 96485 Кл/моль.
Основными условиями выполнения определения кулонометрическим методом являются: – 100 %-ный выход по току, то есть всё электричество, прошедшее через анализируемый раствор, расходуется на электрохимическую реакцию;
– наличие способа определения конца электрохимической реакции. Для обнаружения конечной точки титрования пригодны практически все методы, используемые в титриметрии, – как визуальные, так и инструментальные. Наибольшее применение нашли потенциометрический и амперометрический методы с двумя индикаторными электродами. В качестве химической реакции между кулонометрическим титрантом и определяемым веществом может быть использована любая реакция, применяемая в титриметрии, а именно, реакции кислотно-основного взаимодействия, окисления-восстановления, комплексообразования и осаждения. Кулонометрическими методами можно определять различные неорганические и органические вещества. Основным достоинством метода является высокая чувствительность и точность определения. Он позволяет определять вещества низкой концентрации (10-6 моль/л) с малой ошибкой (0,1…0,05%). К достоинствам метода можно также отнести применение малоустойчивых реагентов, отсутствие эталонов и экспрессность метода.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 2029; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.48.89 (0.009 с.) |