
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Установка для кулонометрического титрованияСодержание книги
Поиск на нашем сайте
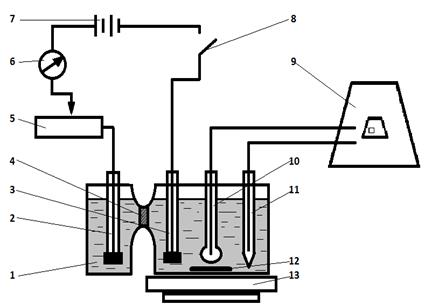
Установка для кулонометрического титрования при постоянной силе тока и рН-метрической индикацией конечной точки титрования приведена на рисунке 5.1. Она состоит из цепи генерации и цепи индикации. В цепь генерации входят: источник постоянного тока (7); магазин сопротивления (5), с помощью которого устанавливается сила тока электролиза; миллиамперметр (6), контролирующий силу тока; ключ (8), замыкающий цепь генерации; два платиновых электрода, один из которых (3), является рабочим, так как на его поверхности генерируется титрант, другой (2) – вспомогательным. Начало формы Конец формы
Рисунок 5.1 – Установка для кулонометрического титрования при постоянной силе тока
Цепь индикации состоит из рН – метра или иономера (9) и двух электродов: стеклянного индикаторного (10) и хлоридсеребряного электрода сравнения (11). Для перемешивания раствора в ячейке (1) используется размешиватель (12) и магнитная мешалка (13). Электролитическая ячейка (1) состоит из катодной и анодной камер, разделённых полупроницаемой пористой стеклянной перегородкой (4). Перегородка служит для разделения продуктов катодной и анодной реакций. Если титрант генерируется на катоде, то электроды цепи индикации погружаются в катодную камеру. Для повышения электропроводности раствора обе камеры заполняются фоновым электролитом.
Определение компонентов технологических растворов и сточных вод Работа 1. Определение примесей кислот в технологических Растворах и водах Цель работы. Определить примеси кислот в технологических растворах и водах методом кулонометрического титрования и оценить случайную составляющую погрешности результата определения. Содержание примесей кислот определяют методом кулонометрического титрования при постоянной силе тока (амперостатическая кулонометрия). Электрогенерируемым титрантом являются ОН – - ионы, которые генерируются на платиновом катоде в результате восстановления воды по электрохимической реакции: 2H2O + 2e– = 2OH– + H2↑ Вода в данном случае является одновременно и растворителем и вспомогательным реагентом, из которого генерируется титрант. Электрогенерированные ОН – - ионы сразу вступают в химическую реакцию с кислотами: Н3О+ + ОН– = 2Н2О. Конечную точку титрования, соответствующую небольшому избытку ОН – - ионов, устанавливают потенциометрическим методом при силе тока I = 0. Индикаторным электродом служит стеклянный электрод (селективный к ионам Н3О +), а вспомогательным – хлоридсеребряный. Схема установки для определения кислот приведена на рисунке 5.1. Для повышения электропроводности раствора определение проводят в присутствии индифферентного фонового электролита K2SO4 с массовой долей 10 %. Расчёт количества определяемых кислот проводят на основе закона Фарадея, который устанавливает связь между количеством вещества, выделившемся на электроде, и количеством израсходованного при этом электричества. В соответствии с приведёнными выше реакциями
n (H3O+) = n (OH–) = Q / F = I · τ / F, где Q – количество электричества, Кл; I – сила тока, А; τ –время генерации, с; F – число Фарадея, равное 96485 Кл/моль.
Порядок проведения работы 1. Подготовка установки к работе. 2. Расчёт объёма пробы анализируемого раствора и разбавление пробы (при необходимости). 3. Проведение предэлектролиза. 4. Кулонометрическое титрование анализируемого раствора и набор статистических данных. 5. Расчёт концентрации определяемого соединения. Задание 1. Коротко записать теоретические основы метода и зарисовать схему установки [1]. Записать приведённые выше условия определения и уравнения реакций. 2. Записать методику определения кислот и рассчитать концентрацию кислот в растворе. 3. Провести математическую обработку результатов определения и представить полученные результаты в виде таблицы 1.1
Методика определения кислот. Для нейтрализации кислот, присутствующих в фоновом электролите, проводят предэлектролиз. Для этого замыкают цепь генерации и при заданном токе генерации I, мА генерируют ОН - –ионы до рН 8. П осле достижения необходимого значения рН цепь генерации размыкают. В катодную камеру пипеткой переносят объем Vn, мл анализируемого раствора. При этом рН раствора уменьшается, так как в ячейку вводится кислота. Одновременно замыкают цепь генерации и включают секундомер. Генерацию ОН – – ионов ведут при токе генерации I, мА. В момент, когда рН раствора достигнет того же значения, что и при проведении предэлектролиза (рН 8), одновременно размыкают цепь генерации и выключают секундомер. Измеряют время электролиза в секундах. Определение повторяют 5 раз. Данные измерения времени, затраченного на электролиз, приведены в таблице 5.1. Содержание кислот в моль/л рассчитывают по формуле:
где I в мА; Vn в мл; 1000 – коэффициенты для перевода мл в л, мА в А.
Значения I = ……. мА; Vn = …..... мл студент получает при выполнении работы. Результаты расчётов записывают в таблицу 5.1, проводят математическую обработку. Таблица 5.1 – Результаты определения содержания кислот в растворе
Работа 2. Определение воды в неводных растворах производства синтетических волокон Цель работы. Определить содержание воды в технологических неводных растворах (регенерированном растворителе типа ДМФА, ДМАА, осадительной ванне) методом автоматического кулонометрического титрования и оценить случайную составляющую погрешности результата определения. Содержание воды определяют методом кулонометрического титрования при постоянной силе тока (амперостатическая кулонометрия) на установке для автоматического титрования на базе кулонометра ОН – 404. Определение основано на реакции взаимодействия SO 2 и I 2 в присутствии H2O в среде пиридин-метанол по химической реакции: SO2 + I2 + H2O = SO3 + 2HI. Сущность определения состоит в следующем. Перед началом определения в анодную и катодную камеры ячейки заливают реактив Фишера (неводные растворы SO2 и I2). Ячейку герметически закрывают. В неё впаяны платиновые электроды цепи генерации. Два платиновых электрода цепи индикации впаяны в анодную камеру. Затем в анодную камеру прибавляют воду в количестве, эквивалентном количеству йода в реактиве. При этом в анодной камере образуется отработанный реактив Фишера (раствор SO3 + HI), в котором нет ни свободного йода, ни воды. Таким образом, отработанный реактив Фишера – это среда для введения пробы анализируемого раствора, а его компонент HI – вспомогательный реагент для получения титранта в процессе электролиза. После этого в раствор отработанного реактива Фишера вводят пробу анализируемого раствора, содержащего воду, и электрохимически генерируют на рабочем электроде (аноде) йод, являющийся титрантом: 2I- - 2e- = I2. Конечную точку титрования, соответствующую небольшому избытку йода, фиксируют потенциометрическим или амперометрическим методом с двумя поляризуемыми электродами. Расчёт содержания воды проводят на основе закона Фарадея, который устанавливает связь в нашем случае между содержанием воды и количеством электричества, пошедшим на генерациюI2. В соответствии с приведенными выше реакциями n (1/2H2O) = n (1/2I2) = Q / F, где n (1/2H2O) – количество молей эквивалента воды, моль; Q – количество электричества,Кл; F – число Фарадея, равное 96485 Кл/моль. Порядок выполнения работы 1. Подготовка установки к работе (проводит инженер лаборатории). 2. Отбор пробы анализируемого раствора микрошприцом в ячейку. 3. Кулонометрическое титрование и набор статистических данных 4. Расчет концентрации содержания воды в анализируемом растворе. Задание 1. Кратко записать теоретические основы метода, записать приведённые выше условия определения и уравнения реакций. 2. Записать методику определения воды и рассчитать концентрацию воды в растворе. 3. Провести математическую обработку результатов определения и представить полученные результаты в виде таблицы 1.1. Методика определения воды. Сухим шприцем отбирают анализируемый раствор и взвешивают его на аналитических весах. Анализируемый раствор вводят в анодную камеру, проколов пробку шприцем. Пустой шприц взвешивают повторно и по разности масс заполненного и пустого шприца определяют массу анализируемого раствора m, г. Включают ток генерации. Генерация йода прекращается автоматически после того, как потенциал в цепи индикации достигнет заданного значения потенциала КТТ на блоке индикации. Количество электричества, пошедшее на титрование Q, Кл, считывают с панели индикации интегратора и заносят в таблицу 5.2. Определение повторяют 5 раз. Содержание воды Cx, % вычисляют по формуле:
где М (1/2Н2О)– молярная масса эквивалента воды, г/моль; 100– коэффициент для выражения массовой доли в %. Таблица 5.2 – Результаты определения содержания воды
5.3. Контрольные вопросы 1. На чем основан метод кулонометрии? 2. Назовите основные условия выполнения анализа методом кулонометрии. 3. Приведите схему установки при постоянной силе тока. 4. Приведите схему установки при кулонометрическом титровании. 5. Объясните суть метода кулонометрического титрования. 6. Какой закон лежит в основе количественных определений в кулонометрии? 7. Как рассчитывают количество определяемого компонента в методе амперостатической кулонометрии? 8. Какие электроды используют в цепи генерации? 9. Назовите способы установления точки эквивалентности при кулонометрическом титровании. 10. Почему необходим 100%-й выход по току в методах кулонометрии? 11. Перечислите основные преимущества кулонометрического метода. 12. Какая пара электродов (рабочий и вспомогательный) будет в цепи генерации при кулонометрическом титровании кислот в растворе? 13. Какая пара электродов (рабочий и вспомогательный) будет в цепи генерации при определении воды методом кулонометрического титрования? 14. Какая пара электродов (индикаторный и электрод сравнения) будет в цепи индикации при кулонометрическом титровании кислот в растворе при потенциометрическом способе установления конца реакции? 15. Какая пара электродов (индикаторный и сравнения) будет в цепи индикации при кулонометрическом титровании воды в растворе при потенциометрическом определении конца реакции? 16. Перечислите способы установления конца реакции при кулонометрическом титровании.
Литература 1. Быкова Л.Н., Новиков А.В., Чеснокова О.Я. Аналитическая химия. / Под ред. Л.Н. Быковой. – М.: МГТУ им. А.Н. Косыгина, 2002. – 411 с. 2. Основы аналитической химии. Практическое руководство: Учеб. пособие для вузов. / Под ред. Ю.А. Золотова. – М.: Высшая школа, 2001. – 463 с. 3. Методические указания к выполнению учебно-исследовательской работы по курсу «Аналитическая химия». Раздел «Математическая обработка результатов количественных определений». – М.: МГТУ им. А.Н. Косыгина, 2002. – 32 с. ПРИЛОЖЕНИЕ
Значения коэффициентов Стьюдента
Учебная литература
Гридина Наталья Николаевна, Новиков Анатолий Владимирович, Баранов Олег Валерьевич
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 512; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.014 с.) |
||||||||||||||||||||||||||||||||||||||||||||||

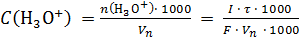 ,
,
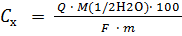 ,
,


