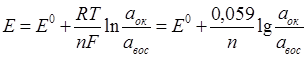Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод градуировочного графикаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
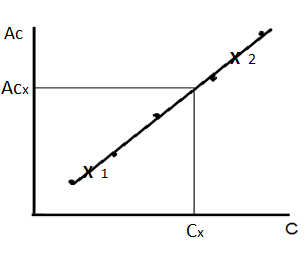
Метод градуировочного графика – это приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы с помощью градуировочного графика. В аналитических определениях чаще всего имеют дело с прямолинейной градуировочной зависимостью. Уравнение прямой имеет вид y = a + bx, где у – аналитический сигнал, х – концентрация (может быть логарифм концентрации), коэффициент а – отрезок, отсекаемый прямой на оси ординат, коэффициент b –тангенс угла наклона прямой. На практике устанавливают градуировочную зависимость путем измерения аналитического сигнала в стандартных растворах. Для проведения анализа необходимо иметь исходный стандартный раствор, который готовят по точной навеске, растворённой в мерной колбе. Если стандартный раствор нельзя приготовить по точной навеске, готовят раствор приблизительной концентрации, а затем устанавливают его концентрацию другим методом анализа. Концентрацию исходного стандартного раствора рассчитывают с четырьмя значащими цифрами. Из исходного стандартного раствора, то есть точно известной концентрации, путем разбавления приготавливают серию стандартных растворов. Во всех приготовленных стандартных растворах измеряют аналитический сигнал. Строят график зависимости аналитического сигнала Ас i от концентрации определяемого компонента С i. Затем измеряют аналитический сигнал в анализируемой пробе, строго соблюдая те же условия определения и режим работы прибора, как в стандартных растворах. По градуировочному графику находят концентрацию определяемого компонента в анализируемом растворе (рисунок 1.1). Более точные результаты получают, если для линейного участка градуировочного графика выводят уравнение Ас = a + b С и по нему рассчитывают концентрацию определяемого компонента. Если измеренный аналитический сигнал превышает верхний предел линейной области графика, то анализируемый раствор разбавляют и повторяют измерения. Необходимую степень разбавления анализируемого раствора выбирают таким образом, чтобы концентрация определяемого компонента в разбавленном растворе и, соответственно, аналитический сигнал попадали в линейную область.
Рисунок 1.1 – Метод градуировочного графика
Построение градуировочного графика Ас = f (С) на миллиметровой бумаге проводят в следующем порядке: 1. Выбирают масштаб с учетом ошибки измерения и отмечают на осях координат ряд чисел, характеризующих масштаб. Значения концентрации С откладывают на оси абсцисс, а значения аналитического сигнала Ас – на оси ординат, указывают единицы измерения физических величин. Экспериментальные значения величин на осях координат откладывать не следует. 2. В координатах Ас – C наносят экспериментальные точки, полученные после измерения Ас в стандартных растворах. 3. Рассчитывают значения коэффициентов a и b для уравнения графика y = a + bx и коэффициент корреляции r, используя данные измерений в стандартных растворах (y = Aci, x = C i). Расчёт проводят методом наименьших квадратов на компьютере (например, в программе Exel) или по формулам [1, c.48]. Записывают уравнение Ас = a + b С, подставив найденные значения коэффициентов a и b. Коэффициент корреляции r отражает корреляцию параметров Ас и С: 4. Строят прямую, описываемую уравнением Ас = a + b С. Для построения достаточно указать координаты двух точек, принадлежащих этой прямой. Подставляют в полученное уравнение любое произвольное значение концентрации (С 1) и рассчитывают соответствующее значение Ас 1 (точка 1), затем для другого произвольного значения С 2 - значение Ас 2(точка 2). Рассчитанные координаты двух точек наносят на график и через них проводят прямую линию, которая оптимально будет отражать линейную зависимость аналитического сигнала от концентрации. Отклонение каждой экспериментальной точки от этой прямой будет минимальным.
Метод стандартов Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности. Метод одного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст. Затем измеряют величины аналитического сигнала этого раствора ( I ст) и анализируемой пробы (Ix) в одинаковых условиях. Исходя из того, что Ix = kCx и I ст = kC ст, получаем:
Из выражения для k выводим формулу для расчёта неизвестной концентрации:
Метод двух стандартов (ограничивающих растворов)
Метод ограничивающих растворов используют в том случае, если концентрация определяемого компонента в анализируемом растворе приблизительно известна и попадает в интервал линейной зависимости показаний прибора (аналитический сигнал) от концентрации. Этим методом пользуются после установления линейности градуировочного графика в определенном диапазоне концентраций. Готовят два стандартных раствора, близких по концентрации к анализируемому раствору Рассчитывают концентрацию определяемого компонента по формуле
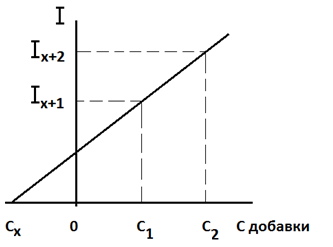
Метод добавок Метод добавок (расчетный и графический) используют в том случае, если известно, что градуировочный график представляет собой прямую линию, выходящую из начала координат. Определение методом добавок заключается в том, что измеряют аналитический сигнал сначала в пробе анализируемого раствора (Iх), а затем к этой пробе добавляют определенное количество стандартного раствора определяемого компонента (добавку) и измеряют аналитический сигнал (Iх +ст). Объем добавки подбирают таким образом, чтобы аналитический сигнал увеличился приблизительно в два раза. Метод однократной добавкиявляется расчётным. Неизвестную концентрацию рассчитывают по формуле
где C ст – концентрация исходного стандартного раствора; V ст – объём стандартного раствора, добавленный к пробе; Vx – объём пробы; Ix и Ix + c т – аналитические сигналы для анализируемого раствора и анализируемого раствора с добавкой стандартного раствора. Определение концентрации методом добавокчаще выполняют графическим способом. Для проведения анализа измеряют величины Ас в пробе анализируемого раствора и в нескольких пробах после добавления к каждой известных количеств стандартного раствора определяемого компонента. Концентрацию добавки в пробах вычисляют по формуле
Строят график в координатах: аналитический сигнал – концентрация добавки, принимая за нуль условно концентрацию компонента в анализируемом растворе без добавки. По графику находят Сх, как абсолютную величину отрезка 0 - С х, отсекаемого прямой на оси абсцисс (рисунок 1.2).
Рисунок 1.2 – Метод добавок Метод добавок используют при анализе проб сложного состава, так как прирост аналитического сигналапри добавке стандартного раствора связан только с определяемым компонентом, а сигналы от мешающих компонентов пробы остаются постоянными [2]. Методы титрования Титрование – процесс постепенного добавления реактива точно известной концентрации (титранта) к раствору определяемого соединения. После каждого добавления порции титранта фиксируют изменение физического свойства раствора. Это может быть предельный диффузионный ток, потенциал индикаторного электрода, оптическая плотность, электрическая проводимость. Соответственно различают амперометрическое, потенциометрическое, фотометрическое, кондуктометрическое титрование. Момент, когда титрант и определяемое соединение будут находиться в эквивалентных количествах, называют точка эквивалентности. Практически устанавливают конечную точку титрования (КТТ), близкую к точке эквивалентности. Процесс титрования изображают графически в виде кривой титрования в координатах: измеряемое свойство раствора – объем титранта. На кривой титрования находят КТТ и соответствующий ей объем титранта, затраченный на титрование пробы анализируемого раствора. Способ нахождения КТТ на кривой титрования зависит от выбранного физико-химического метода анализа. Определив объем титранта в конце титрования (V КТТ), рассчитывают концентрацию определяемого компонента в анализируемом растворе по закону эквивалентности: С 1 V 1 = C 2 V 2,
где С 1и C 2– молярные концентрации эквивалента определяемого компонента и титранта, моль/л, а V 1 и V 2 – объемы пробы титруемого раствора и титранта.
1.3. Математическая обработка результатов определения При выполнении количественного определения, как и при любом измерении, могут возникнуть погрешности двух видов: случайные и систематические. Математическая обработка результатов помогает найти наиболее вероятностное значение определяемой величины и оценить полученные результаты по воспроизводимости и правильности. Понятие воспроизводимость результатов измерений характеризует разброс результатов определения друг относительно друга случайным образом при их повторении, и обусловлено наличием случайных погрешностей. Для оценки воспроизводимости выполняют серию повторных (параллельных) определений и рассчитывают следующие величины: стандартное отклонение S, относительное стандартное отклонение Sr, доверительный интервал δ. Под правильностью понимают близость результата определения х к действительному значению содержания определяемого компонента а. Правильность результата характеризуется систематической погрешностью – отклонением результатов повторных определений от действительного значения на постоянную величину. Математическую обработку результатов определения проводят методами математической статистики для малых выборок, используя следующие формулы и указанную последовательность расчетов: 1. Среднее арифметическое из всех полученных результатов х ср= где xi - единичный результат определения; n – число повторных определений. 2. Стандартное отклонение единичного определения – мера разброса значений измеряемой величины относительно среднего
где 3. Относительное стандартное отклонение 4. Доверительный интервал результата определения – оценка их неопределенности
где Доверительный интервал показывает пределы области среднего значения определяемой величины, внутри которой с вероятностью Р может находиться действительное значение содержания определяемого компонента, при отсутствии систематической погрешности:
Для оценки правильности сравнивают действительное значение а с доверительным интервалом хср ± δ. Если действительное значение а попадает в доверительный интервал, то систематическая ошибка отсутствует и результат считается правильным; погрешность обусловлена только случайными ошибками. 5. Абсолютная ошибка представляет собой разность между действительным значением и найденным значением:
Δабс. = х – α. Относительная погрешность – отношение абсолютной ошибки к действительной величине, выраженной в процентах
Δотн. = (Хср – α) . 100/ α, %. Результат анализа представляют в форме среднего значения из серии параллельных определений с рассчитанным доверительным интервалом: x ср ± δ. Подробные рекомендации и примеры по проведению и оформлению расчетов приведены в пособии [3]. Округление результата определенияx ср ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения. Погрешность результата определения δ принято записывать одной цифрой одной или двумя значащими цифрами: – однойцифрой, если первая цифра погрешности равна 3 или более. – двумяцифрами, если первая из них равна 1 или 2. Результат определения x ср должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности. Например, 20,5 ± 0,4; 0,2236 ± 0, 0015; 10,00 ± 0,24. Обработанные результаты определения представляют в виде таблицы 1.1. Таблица 1.1 - Математическая обработка результатов
2. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Потенциометрические методы анализа основаны на измерении разности потенциалов (ЭДС) между двумя электродами, опущенными в анализируемый раствор. Один электрод является индикаторным, его потенциал зависит от концентрации (активности) определяемого иона. Потенциал другого электрода, который называется электродом сравнения, не зависит от концентрации определяемого иона и в процессе определения остается постоянным. Зависимость равновесного потенциала индикаторного электрода от активности иона в растворе описывается уравнением Нернста:
где Е – равновесный потенциал в реальных условиях, В; Е 0 – стандартный потенциал, В; n – число электронов, участвующих в электродной реакции; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж/К.моль; F – число Фарадея 96500 Кл/моль; а – активность, моль/л. Активность а с концентрацией С связаны соотношением а = jC, где j – коэффициент активности. Для очень разбавленных растворов j → 1 и принимают, что активность почти равна концентрации. В потенциометрии используют два вида индикаторных электродов. 1. Электроды, на поверхности которых или в приэлектродном слое протекают электронообменные процессы. К ним относятся инертные электроды (платиновый, золотой) и металлические электроды 1-го рода (серебряный, медный и др.). 2. Э лектроды, у которых на межфазных границах (мембрана – раствор) протекают ионообменные процессы – ионоселективные (мембранные) электроды (ИСЭ). В качестве электрода сравнения в лабораторной практике чаще всего используют электрод 2-го рода – хлоридсеребряный. Потенциометрические методы разделяют на две группы: методы прямой потенциометрии (ионометрия) и методы косвенной потенциометрии (потенциометрическое титрование). Основным условием выполнения определения потенциометрическим методом является правильный выбор индикаторного электрода. В прямой потенциометрии используют ионоселективные электроды. При потенциометрическом титровании выбор индикаторного электрода зависит от природы определяемого иона и типа химической реакции при титровании.
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 12633; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.195.8 (0.013 с.) |

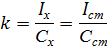
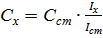 .
.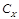 , в одном из которых концентрация определяемого компонента С 1 меньше, а в другом С 2 больше, чем в анализируемом растворе, то есть С1 < С x < C2 . Последовательно измеряют аналитический сигнал в растворах с концентрацией от меньшей к большей, снимая соответственно показания прибора I 1, Ix, I 2.
, в одном из которых концентрация определяемого компонента С 1 меньше, а в другом С 2 больше, чем в анализируемом растворе, то есть С1 < С x < C2 . Последовательно измеряют аналитический сигнал в растворах с концентрацией от меньшей к большей, снимая соответственно показания прибора I 1, Ix, I 2. 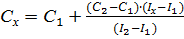 .
. 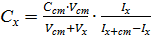 ,
,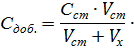
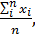
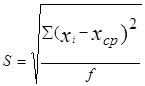 ,
,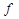 - число степеней свободы показывает число контрольных измерений, воспроизводящих первый результат. Для результатов анализа одной пробы f = n – 1.
- число степеней свободы показывает число контрольных измерений, воспроизводящих первый результат. Для результатов анализа одной пробы f = n – 1. , %.
, %.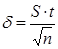 ,
,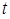 – критерий Стьюдента находят по таблице (см. приложение) в зависимости от уровня доверительной вероятности Р и числа степеней свободы f = n – 1. В аналитической практике принимают Р = 0,95; это означает, что вероятность нахождения действительного значения в пределах доверительного интервала составляет 95%.
– критерий Стьюдента находят по таблице (см. приложение) в зависимости от уровня доверительной вероятности Р и числа степеней свободы f = n – 1. В аналитической практике принимают Р = 0,95; это означает, что вероятность нахождения действительного значения в пределах доверительного интервала составляет 95%.