
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы измерения содержания компонентаСодержание книги
Поиск на нашем сайте
Метрология Методы измерения содержания компонента В пробе вещества объекта анализа
Отчет по лабораторной работе № 10__(ИДЗ № 3)___
по дисциплине Метрология, стандартизация и сертификация
Исполнитель(и) Студент(ы), Окружнова 4Г11
Руководитель (доцент, к.х.н.) (дата)
Томск –2012
Лабораторная работа Метрология Методы измерения содержания компонента В пробе вещества объекта анализа Цель работы: Провести анализ текста методики выполнения измерений концентрации контролируемого компонента в анализируемом веществе конкретного объекта анализа, изложенной в стандарте на методы контроля, или в стандарте технических условий на продукцию в разделе «Методы испытаний (анализа)». Вычленить из текста методики метрологическую и аналитическую части. Описать способ сравнения с эталоном числа частиц контролируемого компонента при определении его содержания в конкретном анализируемом веществе. Составить перечень заданий для метролога, ответственного за обеспечение единства измерений в аналитической лаборатории. Введение Выполнение лабораторной работы по теме «Метрология. Методы измерения содержания компонента в пробе вещества объекта анализа» способствует углубленному освоению студентами теоретических положений изучаемой дисциплины «Метрология, стандартизация и сертификация», темы метрология – наука об измерениях, физическая величина и её измерение, виды и методы измерений, средства измерений, методика выполнения измерений. Данная лабораторная работа является междисциплинарной, так как для её выполнения необходимы основные знания по дисциплине «Аналитическая химия». В то же время выполнение предлагаемой лабораторной работы позволит студентам химико-технологических специальностей понимать метрологическую сущность любых методов и методик химического анализа, которых в настоящее время более сотен тысяч разновидностей. Это будет полезно для более глубокого понимания параллельно изучаемой дисциплины «Аналитическая химия» и физических методов анализа, изучаемых студентами на третьем курсе, а также для выполнения выпускной дипломной работы по специальности. Проделав данную лабораторную работу, студенты получат практические навыки подготовки способа сравнения с эталоном числа химических частиц при использовании химического и физического метода количественного анализа вещества. Рекомендуемая литература 1. Основы аналитической химии и химического анализа (для геологов): учебно-методическое пособие /Н.Н. Чернышова, О.А. Воронова; Национальный исследовательский Томский политехнический университет. – Томск: Изд-во ТПУ, 2012. – 400 с. 2. Метрология, стандартизация и сертификация: учебное пособие / Н.П. Пикула, А.А. Бакибаев, О.А. Замараева, Е.В. Михеева, Н.Н. Чернышова; Национальный исследовательский Томский политехнический университет. – Томск: Изд-во ТПУ, 2010. – 185 с. 3. Чернышова Н.Н. Метрология. Физические величины. Содержание компонента в пробе вещества объекта анализа. Вещество сравнения. Стандартные и градуировочные растворы компонента: методические указания к выполнению лабораторных работ по курсу «Метрология, стандартизация, сертификация» для студентов II курса, обучающихся по направлению 240100 «Химическая технология» и 241000 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии». – Томск: Изд-во ТПУ, 2012. – 20 с. 4. ГОСТ Р 52361-2005 Национальный стандарт Российской Федерации. Контроль объекта аналитический. Термины и определения 5. Шишкин И.Ф. Теоретическая метрология. – М.: Изд-во стандартов, 1991. – 492 с. 6. Основы аналитической химии: учебник в 2 кн. / Под ред. Ю. А. Золотова. – Кн.1: Общие вопросы. Методы разделения – М.: Высшая школа, 2004. – 539 с. 7. ГОСТ 8.417-2002 «Государственная система обеспечения единства измерений. Единицы величин». Internet-ресурсы 8. Пикула Н. П. Метрология, стандартизация и сертификация [Электронный ресурс]: электрон. учеб. / Н. П. Пикула, Н. Н. Чернышова, С. Г. Антонова. – Электрон. дан. – Томск: TPU MOODLE, 2011. – URL: http://mdl.lcg.tpu.ru. 9. Чернышова Н.Н. Метрология, стандартизация, подтверждение соответствия. Презентации лекций. – 2010 (Персональный сайт ТПУ) http://www.portal.tpu.ru/SHARED/n/NNCH/ 10. База данных НТБ ТПУ htth://www.lib.tpu.ru/Kodeks; (Нормы, правила, стандарты; Законодательство Российской Федерации) Задания: Ознакомьтесь с текстом методики выполнения измерений содержания контролируемого компонента в веществе объекта анализа, изложенным в стандарте на методы контроля или в стандарте технических условий на продукцию, выданном преподавателем, проделайте следующие действия и ответьте на вопросы:
Теоретическая часть Ответ на вопрос
В данном методе использован физический способ сравнения с эталоном при Методеоснованном на газохроматографическом разделении метанола и расчете массовой доли воды методом абсолютной градуировки с поправкой на величину фонового сигнала. Метод позволяет определять содержание воды от 0,05% до 0,5%.
Область применения:
2. В нефтяной и газовой промышленности для ликвидации кристаллогидратов в трубопроводах и испытания скважин, а также в химической, фармацевтической, микробиологической промышленности для процессов экстракции, конденсации и др.
Ответ на вопрос
Входная величина – концентрация бора. В первичном измерительном преобразователе формируется пропорциональный ей измерительный сигнал флуоресценции комплексного соединения ионов бората с хромотроповой кислотой (1 Область применения). В промежуточном преобразователе световой сигнал преобразуют в электрический с помощью фотоумножителя [Васильев В.П. Аналитическая химия. Физико-химические методы анализа. – Ч.2. – М.: Высшая школа, 1989. – 384 с.; Аналитическая химия. Физико-химические методы анализа. /Под ред. О.М.Петрухина. – М.: Химия 2001. – 496 с.]. Интенсивность флуоресценции – выходной (аналитический) сигнал регистрируют со шкалы прибора в относительных единицах (6 Порядок проведения определения, 7 Правила обработки результатов определения)
Ответ на вопрос
Вещество сравнения в данной методике анализа представляет собой Государственный стандартный образец состава раствора бора, 1 мг/см
Ответ на вопрос
5 Порядок подготовки к проведению определения 5.4 Приготовление раствора бора 5.4.1 Приготовление раствора бора массовой концентрации 100 мг/дм Для приготовления раствора в мерную колбу вместимостью 50 см 5.4.2 Приготовление раствора бора массовой концентрации 5 мг/дм Для приготовления раствора в мерную колбу вместимостью 100 см 5.6.2 Градуировку анализатора осуществляют измерением интенсивности флуоресценции градуировочного раствора и холостой пробы. 5.6.3 Для приготовления градуировочного раствора в мерную колбу вместимостью 25 см 5.6.4 Для приготовления холостой пробы в мерную колбу вместимостью 25 см 5.6.5 При использовании анализатора, предусматривающего автоматическую градуировку, настройку режима “Фон“ проводят при помощи холостой пробы по 5.6.4; для настройки режима “Калибровка“ используют градуировочный раствор по 5.6.3.
Ответ на вопрос
5.6 Подготовка анализатора к измерениям и его градуировка 5.6.1 Подготовка прибора к работе проводится в соответствии с инструкцией изготовителя. Возбуждение флуоресценции проводится в интервале длин волн 310 – 325 нм, регистрация флуоресценции – в интервале 350 – 375 нм. 5.6.6 Для получения результатов определения бора в “ручном режиме“ вычисляют градуировочный коэффициент
где
Следовательно, градуировочный график для анализатора жидкости флуоресцентного строят в координатах Iфл, отн.ед. – Cm(В), мг/дм
8. Покажите, как можно найти содержание определяемого компонента по градуировочному графику Ответ на вопрос 6 Порядок проведения определения В мерную колбу вместимостью 25 см 7 Правила обработки результатов определения 7.1 При использовании анализатора, допускающего автоматическую градуировку, массовую концентрацию бора в пробе 7.2 При измерениях в “ручном режиме“ массовую концентрацию бора в пробе
где
9. Опишите, как получают результат измерения концентрации определяемого компонента (обратное преобразование)? Ответ на вопрос По результатам измерения с помощью уравнения связи рассчитывают содержание бора в пробе вещества питьевой воды. Уравнение связи представляет собой формулу 2. 7.2 При измерениях в ручном режиме массовую концентрацию бора в пробе
где
Ответ на вопрос Метрологические операции изложены в: 1 Область применения 2 Нормативные ссылки 3 Средства измерения 5 Порядок подготовки к проведению определения 5.4 Приготовление раствора бора 5.5 Приготовление растворов ионов бората 5.6 Подготовка анализатора к измерениям и его градуировка 6 Порядок проведения определения 7 Правила обработки результатов определения 8 Допустимая погрешность определения 8.2 Нормативы контроля точности при вероятности 9 Правила оформления результатов Приложение Б (рекомендуемое). Правила проведения контроля точности Б.1 Контроль воспроизводимости Б.2 Контроль погрешности Аналитические операции изложены в: 1 Область применения 3 …вспомогательное оборудование, реактивы 4 Отбор проб 5 Порядок подготовки к проведению определения 5.1 Приготовление раствора динатриевой соли хромотроповой кислоты молярной концентрации 0,0025 5.2 Приготовление смешанного реагента 5.3 Приготовление раствора гидроокиси натрия с молярной концентрацией 0,1 моль/дм 6 Порядок проведения определения 7 Правила обработки результатов определения Приложение А (обязательное). Подготовка химической посуды для выполнения определений Ответ на вопрос Для получения сопоставимых (достоверных) результатов метролог в процессе измерений содержания бора в питьевой водедолжен обеспечить управляемость окружающих условий, отвечающих метрологическим требованиям. Управляемые условия должны включать в себя: 1. использование измерительного оборудования, имеющего метрологическое подтверждение пригодности (периодическая калибровка (поверка) средств измерений, проверка используемого в процессе измерений программного обеспечения (кроме входящего в состав средств измерений) и вспомогательной аппаратуры, необходимые регулировки или ремонт с последующей калибровкой (поверкой) или проверкой. Стандартные образцы, как исходные эталоны, требуют оценивания характеристики стабильности по методике, установленной в Р 50.2.031-2003 2. обеспечение требуемых условий окружающей среды (температуры, давления, так как измеряют флуоресценцию раствора; освещенность (реагент – раствор динатриевой соли хромотроповой кислоты, используемый для образования аналитической формы соединения, содержащего бор, должен храниться в темноте в нормальных климатических условиях (п.5.1), вибрации, так как используют аналитические весы, запыленности лаборатории, так как работают с растворами, поглощающими частицы пыли; устранение электромагнитных помех и кондуктивных помех питающей электрической сети, так как используют чувствительный к ним анализатор жидкости флуоресцентный); 3. использование компетентного персонала (измерение флуоресценции); 4. проведение мониторинга для метрологического подтверждения пригодности измерительного оборудования и процессов измерений по РМГ 76-2004, Р 50.2.011-2005, РМГ 58-2003, Р 50.4.006-2002. Таким образом, химик-аналитик выполнит измерение концентрации бора в пробе вещества питьевой воды, а метролог обеспечит достоверность полученных результатов измерений. Выводы по проделанной работе: Отчет отправить в папку на рабочий стол: stud anchem: Файл обозначить: № группы_ЛР10_Фамилия студента ( Например, 4Г12_ЛР10_Иванов)
Или отчет отправить преподавателю, проводившему ЛР 10: nnch@tpu.ru,
Метрология Методы измерения содержания компонента
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 150; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.56.181 (0.007 с.) |




 (ГСО состава раствора бора) или государственный стандартный образец состава раствора ионов бората, 1 мг/см
(ГСО состава раствора бора) или государственный стандартный образец состава раствора ионов бората, 1 мг/см 

 по формуле
по формуле (1)
(1) – массовая концентрация бора в образце для градуировки, мг/дм
– массовая концентрация бора в образце для градуировки, мг/дм  – интенсивность флуоресценции градуировочного раствора по 5.6.3, отн. ед.;
– интенсивность флуоресценции градуировочного раствора по 5.6.3, отн. ед.;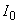 – интенсивность флуоресценции холостого образца по 5.6.4, отн. ед.
– интенсивность флуоресценции холостого образца по 5.6.4, отн. ед. Iфл, отн.ед.
Iфл, отн.ед.
 Cm(В), мг/дм
Cm(В), мг/дм  или массовую концентрацию бора
или массовую концентрацию бора  при помощи анализатора.
при помощи анализатора. (2)
(2) = 0,95 и числе измерений
= 0,95 и числе измерений  = 2
= 2


