
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение статической обменной емкости (СОЕ) катионита.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Приборы и реактивы. 1. колбы на 200мл (2 шт.) 2. катионит в Н+–форме 3. 0,1 н растворы CaCl2, NaOH, HCl
Выполнение работы Берут две навески (по 1 г) предварительно подготовленного ионита с известной влажностью и помещают в конические колбы на 200 мл. Навески берут с точностью до 0,01 г. Затем в одну колбу помещают точно 100 мл 0,1 н CaCl2 , в другую 100 мл 0,1 н раствора NaOH, после чего колбы закрывают и оставляют стоять в течении 10 часов. Периодически содержимое колб осторожно взбалтывают. Затем из них отбирают по 25 мл раствора и титруют в присутствии метилоранжа первый раствор 0,1 н раствором NaOH, второй–0,1 н раствором HCl. Расчет производится по формуле: СОЕ CaCl2= Где а– навеска катионита,г. Для данного случая СОЕ CaCl2 =
СОЕ NaOH=
Определение ОЕ ионитов в динамических условиях (ДОЕ и ПДОЕ) Реактивы: 1. Cu(NO3)2 0.05 н раствор. 2. H2SO4, 2 н раствор 3. KJ, 20%-ый раствор; 4. Na2S2O3, 0,1 н раствор; 5. крахмал, 1%-ный раствор 6. смола в Н+–форме.
Выполнение работы Берут навеску катионита 5 г, помещают в колонку и пропускают через неё 0,05 н раствор соли меди со скоростью 1 капля в секунду. Вытекающий из колонки раствор собирают в мерные колбы на 25 мл (первые 1,0-1,5 мл раствора отбрасывают). В каждой порции вытекающего раствора определяют количество меди иодометрически. Для этого раствор из мерной колбы количественно переносят в колбу для титрования, добавляют 4 мл 2 н H2SO4, 2 г KJ или 10 мл 20%-ого раствора иодида калия и после которого выдерживают раствор в темноте, выделившийся иод оттитровывают 0,1 н раствором Na2S2O3 до желтой окраски. Затем добавляют 2-3 крахмала и продолжают титровать до обесцвечивания синей окраски. Пропускание раствора соли меди через колонку продолжают до тех пор, пока концентрация вытекающего из колонки раствора не станет равной концентрации исходного раствора. По разности титров исходного раствора и фильтратов можно определить количество ионов меди поглощенное сорбентом из каждой порции. Суммируя эти количества по всем порциям и деля полученную величину на навеску ионита, получим значение полной обменной емкости (ПДОЕ). Количество ионов меди, поглощенное ионитом, рассчитывается исходя из всего объема фильтрата, не содержащего ионов меди, и исходной концентрации меди в растворе. Для определения обменной емкости до проскока это количество ионов меди делят на взятую навеску катионита.
ДОЕ= Где Сн(Cu)- нормальность исходного раствора соли меди. V- объем фильтрата, не содержащего меди а- навеска ионита, г ПДОЕ= Где Сн(Сu)- нормальность соли меди V Cu- объем соли, прошедшей через колонку до полного насыщения ионами меди Сн (Na2S2O3)- нормальность тиосульфата натрия V Na2S2O3- общий объем тиосульфата натрия пошедший на титрование аликвотных частей соли меди после прохождения через колонку. а) навеска ионита По данным опыта строят выходную кривую в координатах: концентрации меди (мэкв) в каждой порции фильтрата- мл пропущенного через колонку раствора. ДОЕ определяется площадью прямоугольника, основанием которого является объем раствора, вытекающего из колонки до наступления проскока, а высотой –исходила концентрация обменивающегося иона (мэкв). ПДОЕ выражается площадью над выходной хроматографической кривой. Сравнение заштрихованных площадей показывает, что ПДОЕ больше, чем ДОЕ. 3.1.4. Определение общей концентрации электролита. Растворы: 1. СuSO4, 0.1н раствор 2. HCl, 2 н раствор 3. NaOH, 0.1 н раствор 4. катионит в Н+–форме.
Выполнение работы Определение основано на том, что при пропускании анализируемого раствора через катионит в Н+–форме выделяется кислота в количествах эквивалентном содержанию соли в растворе: 2RH+CuSO4= R2Cu+H2SO4 Выделившуюся кислоту определяют титрованием. Предварительно подготовленный катионит в Н+–форме (5г) помещают в хроматографическую колонку, отмывают дистиллированной водой до нейтральной реакции. Анализируемый раствор соли меди (10 мл) пропускают через катионит со скоростью 1-2 капли в секунду, столько же дистиллированной воды. Промывную воду собирают в одну колбу с фильтратом и оттитровывают 0,1 н раствором NaOH по метилоранжу. Опыт повторяют несколько раз. Взяв средний объем NaOH, затраченный на титрование, рассчитывают содержание меди в исследуемом растворе
MCuSO4=
После окончания определения катионит регенерируют 2 н раствором соляной кислоты.
3.1.5. Определение меди и цинка при совместном присутствии Реактивы: 1. НCl, 3 н раствор 2. (NH4)2C2O4, 0.25 н раствор 3. Н2О2, 6%-ный раствор 4. мурексид, эриохром черный Т 5. раствор, содержащий ионы меди и цинка (0,1 н относительно каждого иона) 6. NH4OH, (25%-ный раствор) 7. ЭДТА, 0,1 н раствор
Ионы меди и цинка образуют комплексные соединения с оксалат–ионом, константы нестойкости которых различны К[Cu(C2O4)2]2-=9.1*10-9, К[Zn(C2O4)2]2-=2.5*10-8. Если колонку, на катионит который предварительно нанесен раствор, содержащий катионы меди и цинка, промыть раствором (NH4)2C2O4, более стойкий анион комплекса меди перейдет в раствор, а ионы цинка останутся связанными с катионитом. Поэтому при промывании слоя катионита раствором (NH4)2C2O4 в фильтрате можно обнаружить только медь. После промывания колонки раствором НCl, вследствие десорбции, ионы цинка будут обнаружены во втором, кислом фильтрате. Выполнение работы. Хроматографическую колонку заполняют заранее подготовленным катионитом KJ–2 в Н+-форме. Затем 4-5мл раствора, содержащего ионы меди и цинка, вливают в колонку. Колонку промывают водой до нейтральной реакции по метилоранжу и затем вводят 40-60мл 0,25н раствора (NH4)2C2O4. Вследствие перехода иона меди в комплекс, весь содержащийся в катионите ион меди вымывается в фильтрат. Последний обрабатывают 6% -ным раствором перекиси водорода (6-7 капель) при нагревании в течение 10 минут. После охлаждения добавляют раствор аммиака до образования медно-аммиачного комплекса (синее окрашивание). Фильтрат после обработки перекисью водорода и аммиаком титруют трилоном Б в присутствии мурексида. В точки эквивалентности окраска резко переходит из желтой (коричневой) в фиолетовую. По количеству затраченного на титрование раствора ЭДТА рассчитывают содержание ионов меди. Оставшийся на катионите цинк удаляют промыванием 3н раствором НС1. расход кислоты составляет примерно 50-60мл. к фильтрату добавляют избыток раствора NH4ОН (35-40мл) и 5,5–6,5г NH4Cl. Полученную смесь разбавляют дистиллированной водой до 100мл и титруют раствором ЭДТА в присутствии эриохрома черного до перехода винно-красной окраски в синюю. По шедшего на титрование рассчитывают содержание ионов цинка в исходном растворе.
3.2. Распределительная хроматография на бумаге В методе бумажной хроматографии разделение веществ происходит вследствие распределения их между водной фазой, содержащейся в целлюлозе, и любой другой подвижной фазой. Последняя не должна смешиваться с водой или может смешиваться с ней очень ограниченно. Для оценки хроматографического поведения веществ в определенных условиях используют величину Rf, которая равна отношению расстояния l, пройденного веществом, к расстоянию, пройденному растворителем L: Rf= l/L. Для расчета Rf выбирают точку в центре пятна. Разделение веществ практически возможно, если Rf(1) - Rf(2 )≤ 0.1. Величина Rf зависит от прирды вещества, состава подвижной фазы, типа бумаги и не должна зависеть от концентрации определяемого иона.
Разделение и обнаружение катионов методом одномерной восходящей хроматографии.
Цель работы: на основании величин Rf и характерной окраски зон определить катионы, присутствующие в одной из следующих комбинаций: 1. Ni2+, Co2+, Cu2+, Cd2+. 2. Ni2+, Mn2+, Pb2+, Zn2+. 3. Cr3+, Ni2+, Co2+,Zn2+. 4. Al3+, Mn2+, Pb2+, Bi3+. 5. Mn2+, Co2+, Cu2+, Cd2+. 6. Ni2+, Co2+, Pb2+, Zn2+. 7. Al3+, Mn2+, Co2+, Bi3+. 8. Cr3+, Al3+, Cu2+, Bi3+. Для системы растворителей HCl – ацетон (8 об. % конц. HCl, 5 об. % воды, 87 об. % ацетона) величины Rf приведены в таблице: Величины Rf для катионов
Аппаратура. Разделение проводят в закрытых камерах, так как необходимо избегать испарения растворителя с полоски хроматографической бумаги. Можно использовать цилиндр с притертой крышкой, к которой с помощью крючка крепится полоска хроматографической бумаги шириной 2 см и длиной 20 см. Система растворителей HCl – ацетон должна быть внесена в цилиндр заранее для насыщения атмосферы камеры парами растворителя. При приготовлении разделяемого раствора в пробирку вносят только по одной капле растворов хлоридов соответствующих катионов. Катионы свинца применяют в виде азотнокислых солей. Используемый раствор может быть с осадком. Нанесение образца на полоску хроматографической бумаги. На расстоянии 2 см от края бумажной полоски карандашом проведите стартовую линию. В середину линии нанесите из капилляра каплю исследуемого раствора с осадком. Капилляр прижмите к бумаге, чтобы капля не расплывалась (чем меньше ее размер, тем более четкой будет хроматограмма). Диаметр пятна обычно составляет 2-3 мм. Пятно обведите карандашом и просушите над песчаной баней. Операцию нанесения образца повторите 2-3 раза. Получение хроматограммы. Полоску хроматографической бумаги с нанесенной каплей исследуемого раствора опустите в цилиндр так, чтобы ее конец был погружен в растворитель не более чем на 0,5см. Пятно не должно погружаться в растворитель, бумажная полоска касаться стенок цилиндра. Время хроматографирования составляет обычно 1,5-2ч. Процесс прекращают после того, как растворитель пройдет от линии старта не менее 10см. После этого бумажную полоску выньте, отметьте положение фронта растворителя и тщательно просушите полоску над песчаной баней. Измерьте расстояние между стартовой линией и фронтом растворителя L. Затем по табличным данным Rf и экспериментально найденной величиной L вычислите l–высоту подъема зоны каждого катиона из заданной комбинации. Обнаружение катионов. Большинство катионов образуют невидимые зоны, поэтому для их обнаружения хроматограмму обрабатывают растворами органических и неорганических реагентов-проявителей (таб.5). Капилляром с реагентом для обнаружения катионов прикасаются только к участку хроматограммы на высоте размещения зоны данного компонента. Появление характерной окраски свидетельствует о присутствии катиона в исследуемом растворе. Таблица 5.
Обнаружение марганца. Соответствующий участок хроматограммы обработайте парами аммиака (образующийся Mn(OH)2 быстро окисляется кислородом воздуха до Mn(OH)2), затем добавьте 1 каплю бензидина. Mn(OH)2 окисляет его, пятно синеет. Обнаружение кобальта. При выполнении этой реакции необходимо вводить большой избыток тиоцианата. Для проявления зоны катиона кобальта на определенный участок полоски нанесите 1 каплю насыщенного раствора тиоцианата аммония или несколько кристалликов этой соли и 1 каплю ацетона. Образуется пятно синего цвета. Обнаружение хрома. С этой целью хром (III) окисляют в хром (VI). В пробирке приготовьте окисленную смесь: к 1капле 2М NaOH прибавьте 1 каплю 3% перекиси водорода. Одну каплю смеси нанесите на участок хроматограммы, соответствующий размещению зоны хрома, затем 1 каплю бензидина. Пятно синеет.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 1753; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.66.64 (0.009 с.) |




 ,
, ,
,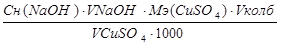 , г
, г


