Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие указания по выполнению практических работ по фотометрииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Внимательно изучите раздел пособия, касающийся выполняемой работы. 2. Строго следуйте методике приготовления растворов: - объемы стандартных растворов определяемого вещества и объемы анализируемых растворов следует отмеривать с максимальной точностью с помощью пипеток или бюреток; - конечные объемы растворов должны быть одинаковыми, для этого используют мерные колбы одинаковой ёмкости; - стандартные и анализируемые растворы желательно готовить в одно и то же время или фотометрирование проводить через определенный временной интервал после приготовления. 3. Кюветы для определения оптической плотности растворов должны быть тщательно очищены перед применением, для этого их моют концентри-рованной соляной кислотой, промывают дистиллированной водой и насухо вытирают снаружи фильтровальной бумагой. Изнутри высушивают кюветы только при работе с органическими растворителями, не смешивающимися с водой. 4. Перед заполнением кюветы фотометрируемым раствором ее ополаскивают небольшим количеством этого раствора во избежание его разбавления. 5. Кювету заполняют до метки на боковой ее поверхности. 6. Кюветы устанавливают в кюветное отделение фотоэлектроколориметра строго в определенное положение, держа ее только за боковые нерабочие грани. 7. По окончании работы необходимо выключить прибор, вымыть кюветы и использованную мерную посуду, привести в порядок рабочее место. 8. Записи в лабораторном журнале рекомендуется делать в следующем порядке: - название выполняемой работы; - формула фотометрируемого соединения; - краткая методика приготовления фотометрируемых растворов; - условия проведения измерения оптических плотностей стандартных и анализируемых растворов; - результаты измерений в виде таблиц и графиков; - обработка результатов измерений, расчет результатов анализа и оценка значений определяемых величин.
Порядок работы на фотоэлектроколориметре КФК-2. Фотоэлектроколориметр КФК-2 предназначен для измерения коэффициентов пропускания (Т,%) и оптической плотности (А) жидких растворов в отдельных участках спектрального диапазона длин волн 315-980 нм, выделяемых светофильтрами.
Принципиальная оптическая схема прибора.
1- осветитель 4,5- объектив 8- защитные стекла 2- конденсор 6- светофильтр 10- пластина-делитель 3- диафрагма 7- кювета 11- фотоприемники Характеристика светофильтров
Порядок работы. Подготовка к работе. 1) Колориметр включить в сеть (вилка и тумблер «сеть»). Открыть кюветное отделение. Прогрев прибора до начала измерений составляет 15 мин. 2) Ввести цветной светофильтр, рекомендуемый методикой, установив рабочую длину волны. 3) Установить минимальную чувствительность: а) ручку «чувствительность» - в положение «1»; б) ручку «установка 100 грубо» - в крайнее левое положение. Внимание! После завершения работ до выключения ручку «чувствительность» установить в положение «1» (красн.), а «установка 100 грубо» - в крайнее левое положение. После этого выключить тумблер «сеть». Измерение. 1) В кюветодержатель помещают кюветы с раствором сравнения (раст-воритель, «холостой раствор» или контрольный раствор, по отношению к которому ведутся измерения) и исследуемый раствор. 2) В световой поток поместить кювету с раствором сравнения. Закрыть кюветное отделение. 3) Ручками «чувствительность», «установка 100 грубо» и «установка 100 точно» выставить 100% пропускание по верхней шкале. Внимание! При измерении со светофильтрами, отмеченными на лицевой панели черным цветом, ручку «чувствительность» установить в положение 1-3, отмеченных также черным цветом, аналогично поступают и в случае светофильтров, отмеченных красным цветом. 4) Поворотом ручки кюветного отделения в световой пучок поместить кювету с исследуемым раствором. 5) Отклонение стрелки от нулевой отметки показывает значение: по верхней шкале – коэффициента пропускания Т, %; по нижней шкале – оптической плотности А.
Работа 1. Исследование колориметрической реакции. Условия проведения фотометрической реакции, приводящей к образованию соединения, поглощающего световую энергию в УФ или видимой области спектра, должны обеспечивать полноту образования светопоглощающего соединения и выполнение основного закона светопоглощения в широком диапазоне концентраций. Оптимизация условий фотометрических измерений предполагает: - выбор длины волны максимального светопоглощения. Для выбора длины волны λmax, которая соответствует наибольшей чувствительности данной фотометрической реакции необходимо получить спектральную характеристику изучаемого раствора, называемую спектром поглощения. - выбор толщины кюветы. - нахождение области линейности градуировочного графика как области подчинения фотометрической системы основному закону светопоглощения. Приборы и реактивы: Фотоэлектроколориметр КФК-2 хромат калия, 5%-ный раствор; рабочий раствор соли никеля(II), содержащий 0,01 мг/мл; йод, 0,05 М раствор; диметилглиоксим, 1%-ный раствор в 20%-ном растворе щелочи; HCl, 1М раствор; рабочий раствор соли меди, содержащий 1 мг/мл Cu2+; для приготовления рабочего раствора навеску 3,931 г CuSO4 ∙ 5H2O растворяют в 25 мл 2м раствора H2SO4, доводят объем раствора до 1,00 л дистиллированной водой; аммиак, 10%-ный раствор. Приготовление фотометрируемых растворов. 1) в мерные колбы, емкостью 50,0 мл помещают 1,0;2,0;3,0;4,0;5,0 мл 5%-ного раствора хромата калия и доводят объем до метки дистиллированной водой; 2) в мерные колбы, емкостью 50,0 мл помещают 2,0;4,0;6,0;8,0;10,0 мл стандартного раствора никеля, а также по 0,5мл раствора йода и по 0,5мл раствора диметилглиоксима и доводят дистиллированной водой до метки. 3) В мерные колбы емкостью 50,0мл помещают 1,0;2,0;3,0;4,0;5,0мл раствора меди, по 10,0мл раствора аммиака и доводят до метки дистиллированной водой. Определение рабочей длины волны. Для выбора длины волны, соответствующей максимальному светопоглощению, измеряют на фотоэлектроколориметре оптические плотности третьих растворов со всеми светофильтрами, кроме первого в кювете с ℓ=1см. Результаты записывают по следующей форме: Таблица 1. Выбор светофильтра для раствора хромата калия (СCrO42-=…мг/мл, ℓ=1см).
Таблица 2. Выбор светофильтра для раствора диметидглиоксимата никеля (СNi=…мг/мл, ℓ=1см).
Таблица 3. Выбор светофильтра для раствора аммиакатамеди (СCu=…мг/мл, ℓ=1см).
По данным таблиц 1-3 строят графики зависимости А=f(λ) и определяют λопт., для которой наблюдается максимальное светопоглощение. Определение интервала линейности градуировочного графика. Измеряют оптические плотности стандартных растворов на выбранной длине волны. Результаты измерений записывают по форме: Таблица 4. Оптические плотности растворов хромата калия (λопт.= … нм, ℓ=1см).
Таблица 5. Оптические плотности растворов диметилглиоксимата никеля (λопт.= … нм, ℓ=1см).
Таблица 6. Оптические плотности растворов аммиаката меди (λопт.= … нм, ℓ=1см).
По данным таблиц 4-6 строят градуировочные графики в координатах А=f(C, мг/мл) и определяют концентрационные области линейности. Рассчитывают чувствительность фотометрического определения как тангенс угла наклона градуировочного графика: H=ΔA/ΔС. Рассчитывают значение коэффициента светопоглощения для фотометрированных растворов по формуле: k =А/Сст.· ℓ Результаты расчета представляют по форме: Таблица 7. Коэффициент светопоглощения растворовхромата калия (λопт.= … нм, ℓ=1см).
Таблица 8. Коэффициент светопоглощения растворов диметилглиоксимата никеля (λопт.= … нм, ℓ=1см).
Таблица 9. Коэффициент светопоглощения растворов аммиаката меди (λопт.= … нм, ℓ=1см).
Значения коэффициентов чувствительности и средние значения коэффициентов поглощения для стандартных растворов: HCrO42- =…, kсредн.= …; HNi- =…, kсредн.= …; HCu=…, kсредн.= ….
Работа 2. Определение никеля с диметилглиоксимом в присутствии окислителей. Метод основан на измерении интенсивности красно-коричневой окраски растворов, которые образуются при взаимодействии ионов никеля (II) с диметилглиоксимом (DH) в присутствии окислителя. В качестве окислителей могут применяться йод, бром, персульфат аммония, пероксид водорода. В условиях проведения реакции происходит окисление никеля, вероятно, до состояния Ni3+. Образование комплекса наблюдается при молярном соотношении количеств Ni:DH = 1:3. Максимальное поглощение наблюдается при λ=470 нм, при этом ε=1.3∙104. Определению мешают вещества, имеющие собственную окраску и катионы, образующие осадки гидроксидов в щелочной среде (Fe,Al,Mg,Cu,Mn). Определение можно проводить в присутствии кобальта, ванадия, молибдена. Приборы и реактивы: стандартный раствор соли никеля(II), содержащий 0.1 мг/мл Ni(II); раствор соли никеля, содержащий 0.01 мг/мл (готовят разбавлением стандартного раствора в день употребления); йод, 0.05 М раствор; диметилглиоксим, 1%-ный раствор в 20%-ном растворе щелочи; HCl, 1М раствор; фотоэлектроколориметр КФК-2. Выполнение работы: Для приготовления эталонных растворов берут 5 мерных колб емкостью 50.0 мл, вводят в каждую 20.0 мл воды, стандартный раствор соли никеля, с содержанием никеля в мг: 0.02; 0.04; 0.06; 0.08; 0.10 соответственно, добавляют 2-3 капли HCl и растворы: 0.5 мл йода, 0.5 мл диметилглиоксима, объем доводят водой до метки колбы. Через 10 минут растворы фотометрируют и строят градуировочный график в координатах А=f(СNi). В качестве раствора сравнения берут воду. Результаты фотометрирования стандартных растворов записывают в таблицу: Таблица 1. Данные для построения градуировочного графика (λопт.=490 нм, ℓ=1см).
Для определения никеля испытуемый раствор помещают в мерную колбу емкостью 50.0 мл. Проводят те же операции с добавлением тех же количеств реагентов, как и при приготовлении стандартных растворов. Определение массы никеля в объеме колбы проводят интерполяцией по ранее построенному графику.
Работа 3. Определение железа (III) с сульфосалициловой кислотой в виде трисульфосалицилата методом добавок.
Железо (III) образует с сульфосалициловой кислотой ряд комплексных соединений в зависимости от кислотности раствора: при рН 1.8-2.5 образуется комплексное соединение фиолетового цвета, имеющее состав 1:1. Максимум светопоглощения моносульфосалицилата железа наблюдается при λ=510 нм молярный коэффициент светопоглощения ε510 =1.8∙103; при увеличении рН до 4-8 образуется комплексное соединение, имеющее состав 1:2; при рН 9.0-11.5 образуется комплекс состава 1:3, растворы которого окрашены в желтый цвет. Трисульфосалицилат железа имеет λmax=416 нм и ε416=5.8∙103; при рН >12 происходит разложение комплексного соединения и выпадение в осадок гидроксида железа. Железо (II) не дает с сульфосалициловой кислотой интенсивной окраски, но вследствие легкой окисляемости ионов железа (II) в железо (Ш) в щелочной среде, можно определять сумму железа (II) и железа (Ш). Комплексные соединения железа с сульфосалициловой кислотой более устойчивы, чем роданидные комплексы железа, что позволяет применять рассматриваемый метод для определения железа в присутствии фосфатов, ацетатов и боратов. В присутствии магния, алюминия, марганца и некоторых других элементов более применим способ определения железа в кислой среде.
Приборы и реактивы: стандартный раствор соли железа (III), содержащий 0.1 мг/мл Fe3+; сульфосалициловая кислота, 10%-ный раствор; серная кислота, 2н раствор; аммиак,10%-ный раствор; азотная кислота (1:1)
Расчетный вариант метода добавок. Выполнение работы. Берут два раствора в мерных колбах на 50.0 мл неизвестной концетрацией железа. К одному из них добавляют 50.0-100.0 мкг железа, в каждую колбу приливают 5.0 мл 10%-ного раствора сульфосалициловой кислоты, 5.0 мл 10%-ного раствора аммиака и доводят объем водой до метки колбы. Через 10 минут измеряют оптическую плотность каждого раствора относительно воды при λ=400 нм. Искомую концентрацию железа(III) вычисляют по формуле: Сx= где Сх – искомая концентрация железа (Ш), Ах- оптическая плотность исследуемого раствора; Ах+д- оптическая плотность исследуемого раствора с добавкой, Сд- концентрация добавки в исследуемом растворе, которую вычисляют по формуле: Сд= Графический вариант метода добавок. Берут 4 аликвоты исследуемого раствора в мерных колбах на 50.0 мл. В аликвоты 2,3 и 4 вводят известные, возрастающие добавки железа (Ш) в количестве 50.0; 100.0 и 150 мкг железа (Ш). Добавляют к каждому раствору по 5.0 мл 10%-ного раствора сульфосалициловой кислоты, затем по 5.0 мл 10%-ного раствора аммиака, доводят водой объем до метки колбы. Через 10 минут измеряют оптическую плотность всех растворов относительно воды и строят график в координатах А = f(Сд), для этого на оси ординат откладывают Ах – оптическую плотность исследуемого раствора без добавки, на оси абсцисс откладывают значения концентраций добавок, приняв за условный ноль концентрацию раствора без добавки. Из точек Сд1, Сд2, Сд3 восстанавливают перпендикуляры, на которых откладывают значения оптических плотностей растврв с добавками: Ах+д1, Ах+д2, Ах+д3. Через полученные точки точки проводят прямую. Экстаполяция прямой до пересечения с осью абсцисс дает отрезок ОСх, величина которого соответствует искомому содержанию железа.
Для уменьшения погрешности определения необходимо, чтобы первая добавка была близка к искомой концентрации, а вторая – в два раза больше первой, в этом случае обеспечивается угол наклона прямой, близкий к 45о.
Работа 4. Определение меди в виде аммиаката методом дифференциальной фотометрии. Метод основан на образовании комплексного соединения ионов меди(II) с аммиаком, обладающего интенсивной сине-фиолетовой окраской. Окраска аммиаката меди обусловлена d→d* переходами вследствие расщепления основного электронного состояния ионов меди в поле лигандов. Процесс взаимодействия ионов меди с аммиаком носит ступенчатый характер: Cu2+ + NH3 ↔ [Cu(NH3)]2+; Cu2+ + 2 NH3 ↔ [Cu(NH3)2]2+; Cu2+ + 3 NH3 ↔ [Cu(NH3)3]2+; Cu2+ + 4 NH3 ↔ [Cu(NH3)4]2+. Так как устойчивость образующихся комплексов различается мало (lg β1=3.99; lg β2=7.33; lg β3=10.61; lg β4=12.03), то в растворе будет находиться смесь нескольких аммиакатов меди, количественное соотношение которых зависит от концентрации аммиака, присутствующего в растворе, что иллюстрируется данными диаграммы:
Для аналитических целей необходимо выбрать такую концентрацию аммиака, при которой в растворе будет преобладать один из комплексов, наиболее эффективно это возможно при lg [NH3] =1. Молярный коэффициент светопоглощения тетрааммиаката меди при λ=640 нм равен 1∙102. Низкое значение ε позволяет определять достаточно высокие концентрации ионов меди. Для повышения воспроизводимости определения используют метод дифференциальной фотометрии, когда раствор сравнения содержит представляет собой раствор, содержащий ионы меди в виде аммиаката, точно известной концентрации. Определению меди в виде аммиачного комплекса мешают ионы металлов, образующие окрашенные комплексы аналогичного типа, например, кобальт и никель, или малорастворимые гидроксиды железа, свинца и алюминия. Для устранения мешающего действия этих элементов применяют маскирующие комплексообразователи. Приборы и реактивы: фотоэлектроколориметр КФК-2; рабочий раствор соли меди, содержащий 1 мг/мл Cu2+; для приготовления рабочего раствора навеску 3.931 г CuSO4 ∙ 5H2O растворяют в 25 мл 2м раствора H2SO4, доводят объем раствора до 1.00 л дистиллированной водой; аммиак, 10%-ный раствор. Приготовление стандартных растворов. Готовят шесть стандартных растворов, содержащих 2.5; 5.0; 7.5; 10.0; 12.5; 15.0 мг меди в 50.0 мл. Для этого в мерные колбы вместимостью 50.0 мл переносят рабочий раствор соли меди, добавляют в каждую колбу 10.0 мл 10% -ного раствора аммиака и доводят объем каждого раствора до 50.0 мл дистиллированной водой. Через 10 минут приступают к измерению оптической плотности. Выполнение работы. Выбор светофильтра. Раствор, имеющий окраску средней интенсивности, фотометрируют относительно воды со всеми светофильтрами поочередно, записывая результаты в таблицу:
По результатам измерений строят график: А=f(λ). Для дальнейшей работы выбирают светофильтр, соответствующий наибольшему значения светопоглощения исследуемого раствора. Посторенние градировочного графика. С выбранным светофильтром поочередно фотометрируют стандартные растворы относительно раствора, содержащего 5.0 мг меди. Если содержание меди в фотометрируемом растворе меньше, чем в растворе сравнения, применяют обратный порядок измерений: фотометрируемый раствор условно принимают за раствор сравнения, устанавливают по нему оптический ноль и по отношению к нему измеряют светопоглощение исследуемого раствора. Найденное значение поглощения берут со знаком «минус». Сочетание прямого (Со>Сх) и обратного (Со<Сх) порядков измерений в дифференциальном методе называют двусторонним дифференцированием. Определение содержания меди(II) в растворе. К анализируемому раствору, содержащему соль меди (II), приливают 10.0 мл 10%-ного раствора аммиака и доводят объем раствора до 50.0 мл дистиллированной водой. Приготовленный раствор через 10.0 мин фотометрируют с выбранным светофильтром относительно выбранного раствора сравнения, содержащего 5.0 мг меди, используя при необходимости приемы двустороннего дифференцирования. Пользуясь градуировочным графиком, находят содержание меди в анализируемом растворе.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 728; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.37.43 (0.009 с.) |

 Фотоэлектроколориметр КФК-2МП.
Фотоэлектроколориметр КФК-2МП.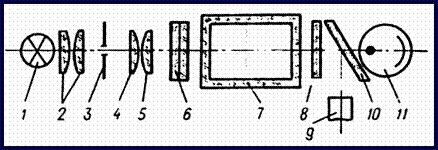
 ,
, .
.