Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фотометрическое определение дихромат- и перманганат-ионов при их совместном присутствии в раствореСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
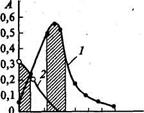
Цель работы: ознакомление с фотометрическим определением элементов при их совместном присутствии методом калибровочного графика. Сущность работы: одновременное определение концентрации двух веществ (хрома и марганца) при их совместном присутствии основано на различии спектров поглощения окрашенных растворов перманганат- и дихромат-ионов. Спектры поглощения определяемых ионов частично накладываются друг на друга (рис.11). В этом случае при фотометрировании с разными светофильтрами можно пренебречь светопоглощением лишь одного из компонентов окрашенной смеси.
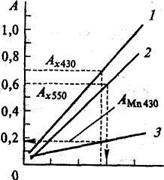
При 550 ± 20 нм поглощает преимущественно перманганат-ион и оптическая плотность А55О обусловлена только перманганат-ионом (незначительным светопоглощением дихромат-иона пренебрегаем). При 430 ± 20 нм поглощают оба аниона и оптическая плотность раствора Ат аддитивно складывается из оптической плотности, обусловленной перманганат-ионом, и оптической плотности, обусловленной дихромат-ионом. Измеряют оптическую плотность стандартных растворов КМпО4 при 550 и 430 нм и оптическую плотность стандартных растворов К2Сг207 при 430 нм. Строятся три калибровочных графика (рис. 12). По величине оптической плотности анализируемого раствора, измеренного в области 550 нм, и калибровочной кривой 2 сразу определяют неизвестную концентрацию марганца. Одновременно при помощи калибровочной кривой 3 определяют оптическую плотность раствора перманганат-иона при 430 нм. Затем по разности оптических плотностей исследуемого раствора и раствора КМnО4, измеренных при 430 нм определяют концентрацию хрома.
Рис. 12Калибровочный график для определения марганца и хрома при их совместном присутствии: / — кривая для определения хрома при 430 им; 2— кривая для определения марганца при 550 нм; 3 — кривая для определения оптической плотности раствора перманганата калия при 430 нм реактивы: 50 %-ная серная кислота; 0,1 н. стандартный раствор КМnО4. Перед применением 9,1 мл стандартного раствора КМnО4 помещают в мерную колбу вместимостью 100 мл и доводят раствор дистиллированной водой до метки. Раствор содержит 0,1 мг марганца в 1 мл. Стандартный раствор K2Cr2O7: навеску 0,2818 г K2Cr2O7 помещают в мерную колбу вместимостью 1 л и доводят раствор дистиллированной водой до метки. Раствор содержит 0,1 мг хрома в 1 мл; исследуемый раствор, содержащий КМnО4 и K2Cr2O7 (по указанию преподавателя). Для построения калибровочного графика в мерные колбы вместимбстью 50 мл помещают с помощью микробюретки 1,0; 2,5; 5,0; 7,5 и 10 мл подготовленного стандартного раствора перманганата калия. Затем добавляют в каждую колбу по 5 мл раствора серной кислоты. Содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Измеряют оптическую плотность полученной серии в кювете толщиной 1 см при длинах волн 550 и 430 нм. Полученные данные помещают в таблицу 4. По полученным данным строят калибровочный график (см. рис.12, кривые 2,3 ): найденные величины оптической плотности откладывают по оси ординат, а соответствующие им концентрации (мг/50 мл) — по оси абсцисс. Затем в колбы той же вместимости помещают такие же количества стандартного раствора дихромата калия. Добавляют в каждую колбу по 5 мл раствора серной кислоты, доводят объем до метки дистиллированной водой и тщательно перемешивают. Измеряют оптическую плотность в тех же кюветах при длине волны 430 нм. Полученные данные помещают в таблицу 4. По полученным данным строят калибровочный график для дихромата калия (см. рис.12, кривая1). Таблица 4
Аликвотную порцию анализируемого раствора (5 мл) помещают в мерную колбу вместимостью 50 мл, добавляют 5 мл серной кислоты. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают. Оптическую плотность полученного раствора измеряют при 430 и 550 нм в кювете толщиной 1 см. В качестве нулевого раствора используют дистиллированную воду. Содержание марганца в растворе определяют по кривой 2(см. рис.12). По найденной концентрации марганца при помощи кривой 3(см. рис. 12) определяют его оптическую плотность при длине волны 430 нм — Аl430 (Мn). Затем находят разность оптической плотности смеси и перманганат-иона при 430 нм по формуле Al430 (Cr) = Аl430 (X) - Аl430 (Мn) где Acr(430) — оптическая плотность смеси, найденная при длине волны 430 нм. По найденной величине при помощи кривой 1вычисляют содержание хрома в исследуемом растворе.
6.7. 10. Определение меди в разбавленных растворах после предварительного концентрирования Ионообменная хроматография позволяет осуществить процессы выделения и концентрирования ионов из разбавленных растворов, не прибегая к трудоемким операциям упаривания, осаждения и пр. На катионите КУ-2 в Н-форме проводят ионный обмен. После поглощения меди ее элюируют раствором кислоты. Медь в растворе определяют фотометрическим методом. Реактивы. Стандартный раствор меди, содержащий 2,0 мг/мл Сu2+. Аммиак NH3, раствор с массовой долей 25%. Кислота хлороводородная HCI, 2М раствор. Переведение катионита в H+-форму. Катионит помещают в делительную воронку, в которой его 5 раз промывают 5%-м раствором НСl для удаления ионов железа. При этом объем промывного раствора должен быть примерно в 30 раз больше объема катионита. Каждый раз катионит взбалтывают с раствором НСl и оставляют в контакте с ним на 2 ч при периодическом перемешивании. После удаления железа промывают катионит дистиллированной водой до нейтральной реакции по метиловому оранжевому. При такой обработке катионит переходит в Н+-форму. Подготовленный таким образом катионит (обычно около 5 г) вносят в хроматографическую колонку. В верхнюю и нижнюю части колонки помещают слой (3—5 мм) стекловаты. Важно, чтобы упаковка ионита в колонке была плотной и равномерной, чтобы не образовывались воздушные пузыри и ионит не всплывал. Необходимо также следить за тем, чтобы катионит всегда находился под слоем воды. Хроматографическую колонку можно использовать многократно, каждый раз перед работой переводя катионит в Н+-форму. Для этого через колонку пропускают 200 мл раствора НСl порциями по 10—15 мл со скоростью 2—3 капли в секунду (скорость истечения регулируют краном). Затем колонку промывают дистиллированной водой до отрицательной реакции на ионы водорода (по метиловому оранжевому или метиловому красному). При повторном (и многократном) использовании колонки ка-тионит не требует регенерации, так как при элюировании меди(П) хлороводородной кислотой катионит переходит в Н+-форму. 2. Проведение ионного обмена. Анализируемый раствор пропускают через хроматографическую колонку с катионитом КУ-2 в Н+-форме со скоростью 1 — 2 капли в 1 с. Раствор, вытекающий из колонки, собирают в стакан и отбрасывают. После этого в колонку вносят 40 мл 2М НСl (порциями по 10 мл) и промывают колонку водой (50—60 мл порциями по 10—15 мл). Вытекающий из колонки раствор собирают в мереную колбу вместимостью 100 мл и доводят до метки водой. 3. Фотометрическое определение меди. Отбирают пипеткой 20 мл раствора, полученного по п. 2, в мерную колбу вместимостью 50 мл, добавляют 15 мл 25%-го раствора NH3, доводят раствор до метки водой. Измеряют оптическую плотность полученного раствора (Аиссл) на фотоколориметре при 600 — 620 нм, подобрав толщину поглощающего слоя I так, чтобы оптическая плотность была равна 0,3—0,5. Для определения молярного коэффициента светопоглощения в мерную колбу вместимостью 50 мл помещают 6 мл стандартного раствора меди (2 мг/мл Сu), 15 мл 25%-го раствора NH3 и доводят до метки водой. Измеряют оптическую плотность полученного раствора (Аст) в условиях, выбранных для исследуемого раствора. Рассчитывают молярный коэффициент светопоглощения. Определяют концентрацию меди в исследуемом растворе. Рассчитывают массу меди в анализируемом растворе с учетом произведенных разбавлений.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 2990; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.111 (0.007 с.) |