
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Титриметрическое определение аскорбиновой кислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 1) В коническую колбу на 50 мл отмерить пипеткой 5 мл молока и 10 мл дистиллированной воды, смесь размешать. 2) В колбу на 50 мл отмерить пипеткой 5 мл смеси, 9 мл дистиллированной воды и 1 мл 2%-ного раствора HCl, тщательно перемешать и оттитровать из микробюретки 0,001 н раствором 2,6-дихлорфенолиндофенола (добавляя его по каплям) до слабо-розового окрашивания, не исчезающего в течение 30-60 секунд. 3) Рассчитать содержание витамина С в молоке по формуле:
где С – содержание витамина С (мг/л); а – количество 0,001 н раствора 2,6-дихлорфенолиндофенола; К – поправка к титру индикатора; 52,8 – постоянный коэффициент. Пример расчетов. На титрование ушло 0,4 мл 0,001 н раствора 2,6-дихлорфенолиндофенола, поправка на титр 1,33.
«Определение солей кальция в молоке» Многие элементы входят в состав живой материи в виде минеральных солей, ионов, комплексных соединений и органических веществ и являются незаменимыми микронутриентами, которые должны ежедневно поступать с пищей. Минеральные вещества участвуют в разнообразных биологических процессах, при этом каждому элементу присущи специфические функции. В зависимости от количества элемента в организме человека и пищевых продуктах их подразделяют на макро- (массовая доля превышает 10-2%) и микроэлементы (массоваядоля составляет 10-3 - 10-5 %). Основными макроэлементами являются кальций, фосфор, магний, натрий, калий, хлор, сера, а микроэлементами- железо, цинк, медь, йод, фтор и другие. Причинами нарушения обмена минеральных веществ, которые могут иметь место даже при их достаточном количестве в пище, являются: - Несбалансированное питание (недостаточное или избыточное количество белков, жиров, углеводов, витаминов и др.); - Кулинарная обработка, вызывающая потери минеральных веществ (например, размораживание в горячей воде, удаление отваров овощей и фруктов); - Отсутствие своевременной коррекции рациона при изменении потребности организма в минеральных веществах; - Нарушение процесса всасывания в желудочно-кишечном тракте. В питании современного человека наиболее дефицитными минеральными веществами являются железо и кальций; а избыточными натрий и фосфор. Среднее содержание микроэлементов в молоке следующее (мг%): кальций- 120, фосфор- 95, калий- 140, натрий- 50, магний- 12, хлор- 100. Соли кальция. Большое значение для человека имеют соли кальция. Кальций в молоке содержится в легкоусвояемой форме и хорошо сбалансирован с фосфором. Около 22% кальция в молоке связано с казеином, остальное количество присутствует в виде фосфатов и цитратов. Фосфаты кальция находятся в основном в коллоидном состоянии, и небольшая часть (30%)- в виде истинного раствора. При сквашивании молока основное количество кальция переходит в сыворотку. Содержание кальция в коровьем молоке зависит от рационов кормления, породы животного, стадии лактации и времени года. Летом содержание кальция ниже, чем зимой. Соли магния. Содержание магния в молоке незначительное- около 12…14 мг%. Доля солей магния, находящихся в виде истинного раствора в молоке, составляет 65…70%. Магний содержится в молоке в тех же химических соединениях и выполняет ту же роль, что и кальций. Определение солей кальция основано на способности комплексона III – Na2H2Y∙2H2O(трилон Б)образовывать в щелочной среде при рН 12-13 комплексные соединения с кальцием, а при рН 10- с кальцием. Анализ выполняют методом обратного титрования.
Цель работы: определить в молоке содержание солей кальция методом обратного комплексонометрического титрования. Реактивы и оборудование: 1) 0,1 М раствор CaCl2; 2) 0,1 М раствор комплексона III (трилон Б); 3) аммиачно-аммонийная буферная смесь, рН 10; 4) 2 н раствор NaOH; 5)эриохромовый черный Т, сухая смесь с хлоридом натрия в массовом соотношении 1:100; 6) мурексид, сухая смесь с хлоридом натрия в массовом соотношении 1:20.; 7) конические колбы для титрования объемом 100…250 мл; 8) бюретки вместимостью 25 мл; 9) мерные цилиндры вместимостью 10 и 100 мл; 10)стеклянный или деревянный шпатель.
Порядок выполнения работы. Одну бюретку заполняют титрованным раствором трилона Б, вторую- стандартным раствором хлорида кальция. В колбу для титрования вместимостью 250 мл помещают 5 мл анализируемого молока, мерными цилиндрами добавляют 90-95 мл дистиллированной воды и 5 мл раствора гидроксида натрия. Из бюретки отмеряют3,5 мл раствора трилона Б, раствор перемешивают и оставляют на 2 мин. Небольшими порциями прибавляют мурексид на кончике шпателя до сиреневой окраски. Анализируемый раствор титруют раствором хлорида кальция, добавляя его по каплям и перемешивая, до появления устойчивой розовой окраски. Измеряют по бюретке объем раствора хлорида кальция, пошедший на титрование, V(CaCl2). Затем из бюретки по каплям добавляют раствор трилона Б до сиреневой окраски, устойчивой в течение 1 мин. Если сиреневая окраска изменяется, добавляют еще каплю раствора трилона Б. По бюретке измеряют общий объем раствора трилона Б, прибавленный в колбу, V(H2Y2-). Расчет. Вычисляют объем раствора трилона Б, вступившего в реакцию с кальцием, V1(H2Y2-):
V1(H2Y2-) = V(H2Y2-) - V(CaCl2) Массовую долю кальция в молоке ω (Са2+), мг%, рассчитывают по формуле:
где m- масса кальция, соответствующая 1 мл раствора трилона Б с концентрацией 0,1 М; m= 2 мг; ρ- плотность молока (0,97 г/мл); Vп – объем пробы молока, мл.
Контрольные вопросы 1. Классификация витаминов. Примеры, формулы. 2. Биологическая роль витамина С. Какие последствия возможны при нехватке витамина С? 3. Какие изменения происходят с витаминами при переработке сырья. Примеры. Какие факторы воздействия наиболее отрицательно влияют на сохранность витаминов? 4. Приведите пути витаминизации продуктов питания. 5. Какую роль играют витамины в организме человека. Примеры. 6. Какие вещества относятся к витаминоподобным? 7. Жирорастворимые витамины. Формулы. Функции. Источники. 8. Водорастворимые витамины. Формулы. Функции. Источники. 9. Приведите определение минеральных пищевых веществ. Классификация. Значение. 10. В чем заключаются основные физиологические функции кальция, и магния. К какой группе минеральных веществ они относятся? 11. Микроэлементы. Значение. Источники. 12. Макроэлементы. Значение. Источники. Лабораторная работа №5 «Определение массовой доли крахмала в колбасных изделиях» Крахмал – полисахарид II порядка, содержится практически во всех пищевых добавках растительного происхождения. Обладая гидрофильностью, он усиливает влагосвязывающую способность мясных фаршей, повышая выход продукта. Ассортимент варёных колбас включает колбасы высшего, 1-ого и 2-ого сортов. Для производства колбас высшего сорта используется высококачественное мясное сырье: говядина жилованная высшего сорта, свинина жилованная нежирная, баранина жилованнаяодносортная, языки свиные и говяжьи и т.д. Внесение в них каких-либо наполнителей типа крахмала или соевых белковых препаратовне предусмотрено. В варёные колбасы 1-го и 2-го сортов и в некоторые низкосортные полукопчёные и ливерные колбасы и сардельки добавляют крахмал или пшеничную муку. Крахмал снижает пищевую ценность колбас, и по этому его количество не должно превышать 2-3%. Мука, крахмал - наполнители. Они устраняют бульонные отеки, придают монолитность и увеличивают выход, могут стать причиной резиноподобной консистенции, "пустого" вкуса. Определение крахмала в колбасных изделиях основано на окислении альдегидных групп моносахаридов, образующихся при гидролизе крахмала в кислой среде, двухвалентной медью реактива Фелинга с образованием осадка закиси меди. При гидролизе крахмала образуются редуцирующие сахара, основную массу которых составляет глюкоза.
(С6Н10О5)n + nH2O®n(C6H12O6)
Образовавшиеся при гидролизе крахмала редуцирующие сахара, благодаря наличию альдегидных групп, окисляются в щелочной среде реактивом Фелинга - растворимым комплексным соединением меди (II) с сегнетовой солью. При окислении глюкозы Сu (II) восстанавливается до закиси меди Сu2О.
Количество восстановленной меди соответствует разнице содержания окисной меди в холостом опыте и после кипячения с раствором инвертного сахара. Содержание общего и остаточного количества окисной меди определяется йодометрически с индикатором – крахмалом: I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Цель работы: определить массовую долю крахмала в различных пищевых добавках и мясных продуктах. Реактивы и оборудование: 1) технические весы; 2) электрическая плитка; 3) водяной или воздушный холодильник; 4) бюретка на 25 мл; 5) мерные колбы на 50, 100, 250 мл; 6) конические колбы на 100 и 250 мл; 7) пипетки на 2, 10 и 25 мл. 8) 10%-ный раствор соляной кислоты; 9) 10%-ный раствор гидроксида натрия; 10) 15%-ный раствор гексацианоферрата (II) калия; 11) 30%-ный раствор сульфата цинка; 12) диэтиловый эфир; 13) раствор Фелинга; 14) 30%-ный раствор иодида калия; 15) 25%-ный раствор серной кислоты; 16) 0,1 М раствор тиосульфата натрия; 17) раствор крахмала; 18) индикатор фенолфталеин.
Порядок выполнения работы Навеску образца продукта массой ~20 г, взвешенную с точностью до 0,01 г, помещают в круглодонную колбу на 250 мл и приливают небольшими порциями 80 мл раствора соляной кислоты при постоянном помешивании стеклянной палочкой. Колбу с содержимым присоединяют к обратному водяному или воздушному холодильнику, ставят на электроплитку, подложив под колбу асбестовую сетку, нагревают до кипения и 15 мин кипятят. Затем колбу охлаждают до комнатной температуры холодной водой и содержимое количественно переносят в мерную колбу на 250 мл и доводят объем жидкости в колбе до метки дистиллированной водой таким образом, чтобы попавший в колбу жир находился над меткой.После перемешивания содержимое колбы фильтруют через бумажный фильтр. Вносят пипеткой 25 мл фильтрата в мерную колбу на 50 мл, добавляют 1 каплю раствора индикатора фенолфталеина и нейтрализуют раствором гидроксида натрия до появления от одной капли щелочи красноватой окраски. Сразу же добавляют в колбу по каплям раствор соляной кислоты до исчезновения красноватой окраски и еще 2-3 капли этой же кислоты для установления слабокислой реакции раствора. Для осветления гидролизата и осаждения белков к раствору в колбе на 50 мл пипеткой добавляют 1,5 мл раствора гексацианоферрата калия (реактив КаррезаI) и 1,5 мл раствора сульфата цинка (реактив КаррезаII). Содержимое колбы охлаждают до комнатной температуры, доводят объем дистиллированной водой до метки, перемешивают и фильтруют через бумажный фильтр (в случае образования пены добавляют 1-2-капли серного эфира). В две мерные колбы на 100 мл добавляют: в одну - 10 мл прозрачного бесцветного фильтрата, в другую - 10 мл дистиллированной воды (для приготовления контрольного раствора). Затем в каждую колбу добавляют по 20 мл раствора Фелинга, полученного смешиванием (1:1) растворов Фелинга-1 и Фелинга-2. Содержимое колбы взбалтывают и кипятят на электроплитке 3 мин, считая с момента закипания. После кипячения колбы охлаждают холодной водой, доводят объемы дистиллированной водой до метки, тщательно перемешивают и дают осесть выпавшему оксиду меди. В коническую колбу вместимостью 100 мл пипеткой вносят 20 мл отстоявшейся жидкости, последовательно добавляют мерным цилиндром сначала 10 мл 30%-ного раствора йодистого калия, затем 10 мл 25%-ного раствора серной кислоты и сразу же титруют выделившийся йод раствором тиосульфата натрия до слабо-желтой окраски. Затем добавляют 1 мл раствора крахмала и продолжают медленно титровать (с промежутком между каплями 5-6 с) до полного исчезновения синей окраски раствора. Затем производят титрование контрольного раствора. Расчеты: 1) Объем 0,1 М раствора тиосульфата натрия Vx (в мл), пошедшего на титрование образующегося в ходе реакции йода, рассчитывают по формуле:
где К – коэффициент пересчета на точно 0,1 М раствор тиосульфата натрия; Vк, Vи – соответственно, объемы 0,1 М раствора тиосульфата натрия, израсходованного на титрование контрольного и испытуемого растворов, мл; 100 – разбавление гидролизата после кипячения, мл; 20 – объем титруемого раствора, мл. По таблице 1 находят массу крахмала (a, мг), соответствующую массе тиосульфата натрия (Na2S2O3), содержащегося в 1 мл 0,1 М раствора. 2) Рассчитывают массовую долю крахмала w (%) по формуле:
где a - масса крахмала, соответствующая массе тиосульфата натрия, содержащегося в 1 мл 0,1 М раствора (определяют по табл. 1), г; 250 – объем гидролизата, мл; 50 – разведение фильтрата после нейтрализации и осаждения белков, мл; m – масса навески образца, г; 25 – объем фильтрата, взятый для нейтрализации и осаждения белков, мл; 10 – объем гидролизата, взятый для кипячения, мл.
Таблица 1 Взаимосвязь массы крахмала, содержащегося в анализируемом продукте и объема раствора тиосульфата натрия, пошедшего на титрование
Расхождение между результатами параллельных определений не должно превышать 0,2%. За окончательный результат принимают среднее арифметическое результатов трех параллельных определений. Вычисление производят с точностью до 0,1%. После выполнения работы и расчетов студенты делают заключение о соответствии продукта требованиям государственного стандарта по массовой доле крахмала в анализируемом продукте. Примечание. При вычислении содержания крахмала в ливерной яичной колбасе найденный процент умножают на 0,7 (поправочный коэффициент на содержание редуцирующих веществ в продукте). При анализе растительных добавок делают расчет количества добавки в фарше для получения качественной продукции, соответствующей государственному стандарту. Пример расчетов: на титрование 20 мл контрольного раствора израсходовано 3,21 мл 0,1 М раствора тиосульфата натрия (К = 0,9877), а на титрование 20 мл анализируемого раствора - 2,18 мл:
По таблице 1 находим массу крахмала, соответствующую 5,09 мл 0,1 М раствора тиосульфата натрия:
где 14,2 - масса крахмала, соответствующая 5 мл 0,1 М раствора Na2S2O3, мг; 2,9 - разность значений массы крахмала для 5 и 6 мл раствора Na2S2O3, мг; 0,261 - масса крахмала, соответствующая 0,09 мл 0,1 М раствора Na2S2O3, мг.
Таким образом, массовая доля крахмала в анализируемом продукте равна 3,62%. Контрольные вопросы
1. Какие добавки входят в группу веществ, изменяющих структуру и физико-химические свойства пищевых продуктов? Классификация. Примеры. 2. Какие основные виды модификаций крахмалов вы знаете? Как строение модифицированных крахмалов связано с особенностями их свойств? 3. Какую химическую реакцию проводят для получения из крахмала моносахаридов? Составьте уравнение реакции, назовите продукты реакции. 4. Напишите уравнение реакции окисления альдегидных групп моносахаридов. 5. Вещества, улучшающие внешний вид продуктов. Группы. Примеры. Значение. 6. Вещества, увеличивающие срок годности. Классификация. Примеры. Значение. 7. Вещества, влияющие на вкус аромат. Классификация. Примеры. Значение. 8. 8. БАД. Классификация. Примеры. Значение.
Список использованной литературы. 1. Руководство по методам анализа качества и безопасности пищевых продуктов / под ред. Скурихина И.М., Тутельяна В.А. – М.: Брандесс Медицина, 1998. – 342 с. 2. Химический состав российских пищевых продуктов: Справочные таблицы / под ред Скурихина И.М., Тутельяна В.А.– М.: ДеЛипринт, 2002. – 236 с. 3. Методические указания к выполнению лабораторных работ по курсу «Пищевая химия» (для студентов технологических специальностей) / под ред. А.П. Нечаева. – М.: Издательский комплекс МГАПП, 1994. – 38 с. 4. Кобелева И.Б., Вяльцева И.В., Фуголь О.А. Методические указания и контрольные задания по курсу «Пищевая химия» (для студентов заочной формы обучения). – М.: Издательский комплекс МГУПП, 1999. – 90 с.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 703; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.011 с.) |

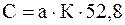

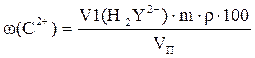

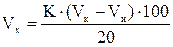 ,
,
 ,
, = 0,9877×(3,21-2,18)×5 = 5,09 мл
= 0,9877×(3,21-2,18)×5 = 5,09 мл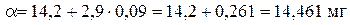 ,
, = 0,014461×250 = 3,62%
= 0,014461×250 = 3,62%


