
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие правила работы в лабораторииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра химии
ОПД. Ф. 10ХИМИЯ ПИЩИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к выполнению лабораторных работ
Направление подготовки дипломированного специалиста 655900 – Технология сырья и продуктов животного происхождения
Уфа 2012
Рекомендовано к изданию методической комиссией факультета пищевых технологий
(протокол № от «____» __________ 2012 г.)
Составитель: Чернышенко Ю.Н.
Ответственный за выпуск: заведующий кафедрой химии Исламова Р.М.
Оглавление
ВВЕДЕНИЕ
Методические указания к лабораторным работам по дисциплине «Химия пищи» предназначены для студентов факультета пищевых технологий и составлены в соответствии с программой подготовки дипломированного специалиста по направлению 655900 - Технология сырья и продуктов животного происхождения. Каждая лабораторная работа выполняется студентами индивидуально и проводится в течение 4-х часов в следующей последовательности: 1) студент дома самостоятельно знакомится с целью работы, изучает методическое указание и соответствующую учебную литературу, оформляет описательную часть отчета; 2) на занятии студент получает задание у преподавателя и приступает к выполнению работы; 3) после завершения работы студент приводит рабочее место в порядок, делает необходимые расчеты, заканчивает оформление отчета и сдает его преподавателю. Работа считается выполненной студентом только тогда, когда отчет со всеми результатами и сделанными на основании их выводами принят преподавателем. Предлагаемые методические указания составлены на основе опыта проведения лабораторных занятий на кафедре химии Башкирского государственного аграрного университета.
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ И ТЕХНИКА БЕЗОПАСНОСТИ 1. Перед каждой лабораторной работой следует изучить относящийся к ней теоретический материал. Только тогда лабораторные занятия будут полезными и продуктивными. 2. Начинать опыты следует только после внимательного ознакомления с описанием работы и уяснив технику ее выполнения. 3. Не брать реактивы в большем количестве, чем требуется для проведения опыта. 4. Неизрасходованные или взятые в избытке реактивы не рекомендуется сливать обратно в бутыли или другую тару; их необходимо сдавать лаборанту. 5. Не загромождать рабочее место посторонними предметами или реагентами. 6. Не уносить приборы и аппараты, а также реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место сразу после его использования. 7. Все работы с вредными веществами проводить только под вытяжным шкафом. Нельзя переносить концентрированные кислоты и щелочи с одного места на другое. 8. Не путать пробки от склянок, а также пипетки для отбора жидких реактивов. 9. Горячие приборы и посуду ставить только на специальные подставки, а не на стол. 10. По окончании работы необходимо вымыть химическую посуду, тщательно убрать рабочее место, отключить воду и электричество. 11. Обязательно вести запись результатов, проведенных лабораторных работ. Пока в тетрадь не занесены результаты предыдущего опыта, не переходить к следующему. 12. При нагревании пробирок и колб с их содержимым во избежание выброса жидкости нельзя направлять их отверстием к себе или в сторону соседа. 13. Если на кожу попала концентрированная кислота, то пораженное место следует тотчас же промыть обильным количеством воды под краном, после чего обработать 5%-ным раствором соды. 14. В случае попадания концентрированной щелочи пораженное место следует промыть водой, затем разбавленным раствором уксусной кислоты. 15. При получении ожогов от прикосновения к горячим предметам надо обожженное место покрыть марлей, пропитанной 2%-ным раствором перманганата калия или 3%-ным раствором танина. 16. При порезах рук стеклом следует в первую очередь удалить из раны осколки стекла, затем смыть кровь 2%-ным раствором перманганата калия или спиртом и, смазав рану йодной настойкой, забинтовать. 17. Испытывать газы на запах нужно осторожно: пробирку следует держать в полувытянутой левой руке так, чтобы отверстие находилось ниже уровня носа, и правой рукой направлять к себе слабый ток воздуха. 18. Огнеопасные вещества, такие, как водород, бензин, эфир, надо держать подальше от источника открытого огня. Порядок выполнения работы.
Опыт 1. Проба на образование пятна. Каплю исследуемого жира наносят стеклянной палочкой на фильтровальную бумагу. Появляется сальное пятно, которое не исчезает при нагревании, что свидетельствует о наличии жира.
Опыт 2. Омыление жира. Жиры под влиянием щелочей гидролизуются с образованием калиевых солей жирных кислот (мыла) и глицерина:
1 мл растительного масла смешивают в пробирке для гидролиза с 20 мл спиртового раствора едкого кали. Пробирку нагревают на кипящей бане, закрыв пробкой с длинной стеклянной трубкой (в качестве обратного холодильника), до полного омыления (примерно 60 мин.). Показателем полноты омыления может служить отсутствие образования жирных пятен на поверхности воды, в которую добавлена капля гидролизата. Гидролизат разводят до 20 мл дистиллированной водой и полученный раствор используют для выявления составных частей жира, жирных кислот и глицерина.
Опыт 3. Открытие жирных кислот. Для обнаружения жирных кислот используют гидролизат, полученный в опыте 3.
Опыт 3.1. В первую пробирку к 1 мл гидролизата приливают равное количество воды и взбалтывают. Образуется стойкая пена, которая указывает на присутствие в гидролизате растворенного калийного мыла, обладающего способностью понижать поверхностное натяжение растворов.
Опыт 3.2. Во вторую пробирку к 1 мл гидролизата добавляют несколько капель 5%-ного раствора хлорида кальция. Выпадает белый осадок нерастворимого кальциевого мыла.
Опыт 3.3. В третью пробирку к 1 мл гидролизата прибавляют несколько капель 10%-ного раствора ацетата свинца. Выпадает осадок свинцовых солей жирных кислот, который при нагревании становится вязким (свинцовый пластырь).
Опыт 3.4. В четвертую пробирку к 2 мл гидролизата добавляют 0,5 мл концентрированнойHCl. Образующиеся жирные кислоты нерастворимы в воде и будут собираться в верхней части содержимого пробирки.
Опыт 3.5. В пятую пробирку к 2 мл гидролизата добавляют несколько капель 10%-ного раствора H2SO4 (осторожно!). Выпадает белый осадок свободных жирных кислот. Содержимое этой пробирки фильтруют и оставляют для открытия глицерина.
Опыт 4. Открытие глицерина. К остатку профильтрованного гидролизата добавляют 8-10 капель 10%-ного раствора NaOH и 1-2- капли 2%-ного раствора сульфата меди. Появляется слабо-синее окрашивание, которое вызвано образованием глицерата меди:
Лабораторная работа №2 «Кислотный гидролиз крахмала и идентификация продуктов гидролиза»
Введение
Тонкослойная хроматография (ТСХ, TLC) - один из наиболее используемых методов хроматографического анализа. Она широко используется для качественного анализа смесей, в основном, за счет дешевизны и скорости получения результатов. Основой тонкослойной хроматографии является адсорбционный метод, хотя также встречается метод распределительной хроматографии. Адсорбционный метод основан на различии степени сорбции-десорбции разделяемых компонентов на неподвижной фазе. Адсорбция осуществляется за счет ван-дер-вальсовских сил, являющейся основой физической адсорбции, полимолекулярной (образование нескольких слоев адсорбата на поверхности адсорбента) и хемосорбцией (химического взаимодействия адсорбента и адсорбата). В этом методе хроматографирование веществ происходит в тонком слое сорбента, нанесенного на твердую плоскую подложку. Разделение в этом методе в основном происходит на основе сорбции-десорбции. В основном используются пластины заводского изготовления, имеющие достаточно широкий ассортимент как по размерам и носителям, так и по подложкам. Современная хроматографическая пластинка представляет собой основу из алюминия или полимера (напримерполитерефталат). Для закрепления сорбента применяют гипс, крахмал, силиказоль и др., которые удерживают зерна сорбента на подложке. Толщина слоя может быть различна (100 и более мкм), но самый важный критерий - слой должен быть равномерный по толщине в любом месте хроматографической пластинки. Наиболее распространенным сорбентом является силикагель. Силикагель - гидратированная кремниевая кислота, образующаяся при действии минеральных кислот на силикат натрия и сушкой образовавшегося золя. После размалывания золя используют фракцию определенной зернистости (указанную на пластинке, обычно 5-20 мкм). Силикагель является полярным сорбентом, у которого в качестве активных центров служит группы -ОН. Он легко сорбирует на поверхности воду и образует водородные связи. В тонкослойной хроматографии, в качестве подвижной фазы используют либо чистые вещества (этилацетат, бензол и т.п.), либо смеси веществ (системы) в определенном соотношении.
Хроматографирование
Тонкослойная хроматография имеет несколько способов, связанных, в основном, с видом движения растворителей: - восходящая тонкослойная хроматография; - нисходящая тонкослойная хроматография; - горизонтальная тонкослойная хроматография; - радиальная тонкослойная хроматография. В данной лабораторной работе мы будем использовать восходящую тонкослойную хроматографию.
Порядок выполнения работы. Опыт 2. Гидролиз крахмала. При нагревании крахмала с разбавленными кислотами происходит его гидролиз по следующей схеме: (С6Н10О5)х ® (С6Н10О5)y® С12Н22О11® С6Н12О6 крахмал декстрины мальтоза глюкоза где у < х.
В мерную пробирку помещают 2 мл крахмального клейстера и 6 капель раствора серной кислоты. Содержимое пробирки встряхивают и ставят в стакан на 50 мл с кипящей водой. Каждые 2 минуты отбирают пипеткой каплю раствора и переносят в пробирку с раствором йода. Для этого предварительно в 8 пробирок помещают по одной капле раствора йода и 5 капель воды. Последовательные пробы обнаруживают постепенное изменение окраски при реакции с йодом (синюю, сине-фиолетовую, красно-фиолетовую, красновато-оранжевую, оранжевую и желтую). Крахмал с йодом дает синее окрашивание. Декстрины, в зависимости от величины цепочки, с йодом окрашиваются в фиолетовые, красные и оранжевые цвета. Мальтоза и глюкоза не изменяют окраски йода. Гидролиз крахмала заканчивают, когда крахмальный клейстер не будет давать цветной реакции с йодом. Отмечают общую продолжительность гидролиза. По окончании гидролиза проводят анализ реакционной среды методом ТСХ. Опыт 3. Метод ТСХ. На подготовленную пластинку для ТСХ «Силуфол» с помощью хроматографического шприца или капилляра наносят гидролизат в виде точки, рядом (с обеих сторон от точки гидролизата) наносят пробы свидетелей – раствор мальтозы и раствор глюкозы (при проведении исследований веществ с предполагаемым составом, применяют метод хроматографирования со свидетелем - известным веществом). Линию финиша отмечают, отступив 5 мм от верхнего края пластинки.
Пластинку вертикально помещают в камеру, которая заполнена разделяющей смесью до высоты 5 мм. Состав разделяющей смеси: н -бутанол – уксусная кислота – вода (60 мл – 15 мл – 25 мл). Пластинку выдерживают в камере до тех пор, пока высота подъема фронта восходящего растворителя не достигнет отмеченной длины разделительного пути (линия финиша). По окончании хроматографического разделения пластинку вынимают из камеры и сушат при комнатной температуре в вытяжном шкафу до полного испарения остатков растворителей. Затем разделение повторяют в той же системе растворителей. Высушенные пластинки погружают в реагент, представляющий собой смесь: н -бутанол –водоуксусная кислота – фосфорная кислота – анилин – дифениламин (60 мл – 25 мл – 15 мл – 10 мл – 1 мл – 2 г). Пластинки снова сушат и проявляют в термостате при температуре 1200С в течение 5 мин. Идентификацию продуктов гидролиза проводят с помощью свидетелей и по значениям Rf. Данные заносят в таблицу 3.
Таблица 3.
Контрольные вопросы. 1. Роль моно-, олиго- и полисахаридов в пищевых продуктах. 2. Кислотный гидролиз крахмала. Какие продукты образуются при гидролизе? Недостатки кислотного гидролиза. Схема реакции. Формула крахмала. 3. Гидролиз крахмала амилолитическими ферментами: a- и b-амилазами, глюкозоамилазой. Особенности ферментативного гидролиза крахмала.Схема реакции. Формула крахмала 4. На чем основано хроматографическое разделение смеси веществ? Что такое элюент? Как рассчитывается величина Rf? 5. Приведите классификацию углеводов. Напишите формулы для каждой приведенной Вами группы. 6. Пищевая и энергетическая ценность углеводов. 7. Реакция Майяра. Начальная стадия. 8. Реакция Майяра. Перегруппировка Амадари. 9. Реакция Майяра. Образование дифруктозоглицина. 10. Образование 3-дезоксиглюкозона. 11. Реакция карамелизации. 12. Образование оксиметилфурфурола.
Лабораторная работа №3 Порядок выполнения работы.
Контрольные вопросы 1. Влияние воды на качественные характеристики мясопродукта. 2. Какие методы аналитического определения содержания воды Вы знаете? 3. Свободная и связанная влага в пищевых продуктах, методы ее определения 4. Активность воды и стабильность пищевых продуктов. 5. Влияние активности воды на скорость реакций в пищевых продуктах и рост микроорганизмов. 6. Лед и его роль в стабильности пищевых продуктов. Лабораторная работа № 4 Порядок выполнения работы Порядок выполнения работы. Одну бюретку заполняют титрованным раствором трилона Б, вторую- стандартным раствором хлорида кальция. В колбу для титрования вместимостью 250 мл помещают 5 мл анализируемого молока, мерными цилиндрами добавляют 90-95 мл дистиллированной воды и 5 мл раствора гидроксида натрия. Из бюретки отмеряют3,5 мл раствора трилона Б, раствор перемешивают и оставляют на 2 мин. Небольшими порциями прибавляют мурексид на кончике шпателя до сиреневой окраски. Анализируемый раствор титруют раствором хлорида кальция, добавляя его по каплям и перемешивая, до появления устойчивой розовой окраски. Измеряют по бюретке объем раствора хлорида кальция, пошедший на титрование, V(CaCl2). Затем из бюретки по каплям добавляют раствор трилона Б до сиреневой окраски, устойчивой в течение 1 мин. Если сиреневая окраска изменяется, добавляют еще каплю раствора трилона Б. По бюретке измеряют общий объем раствора трилона Б, прибавленный в колбу, V(H2Y2-). Расчет. Вычисляют объем раствора трилона Б, вступившего в реакцию с кальцием, V1(H2Y2-):
V1(H2Y2-) = V(H2Y2-) - V(CaCl2) Массовую долю кальция в молоке ω (Са2+), мг%, рассчитывают по формуле:
где m- масса кальция, соответствующая 1 мл раствора трилона Б с концентрацией 0,1 М; m= 2 мг; ρ- плотность молока (0,97 г/мл); Vп – объем пробы молока, мл.
Контрольные вопросы 1. Классификация витаминов. Примеры, формулы. 2. Биологическая роль витамина С. Какие последствия возможны при нехватке витамина С? 3. Какие изменения происходят с витаминами при переработке сырья. Примеры. Какие факторы воздействия наиболее отрицательно влияют на сохранность витаминов? 4. Приведите пути витаминизации продуктов питания. 5. Какую роль играют витамины в организме человека. Примеры. 6. Какие вещества относятся к витаминоподобным? 7. Жирорастворимые витамины. Формулы. Функции. Источники. 8. Водорастворимые витамины. Формулы. Функции. Источники. 9. Приведите определение минеральных пищевых веществ. Классификация. Значение. 10. В чем заключаются основные физиологические функции кальция, и магния. К какой группе минеральных веществ они относятся? 11. Микроэлементы. Значение. Источники. 12. Макроэлементы. Значение. Источники. Лабораторная работа №5 «Определение массовой доли крахмала в колбасных изделиях» Крахмал – полисахарид II порядка, содержится практически во всех пищевых добавках растительного происхождения. Обладая гидрофильностью, он усиливает влагосвязывающую способность мясных фаршей, повышая выход продукта. Ассортимент варёных колбас включает колбасы высшего, 1-ого и 2-ого сортов. Для производства колбас высшего сорта используется высококачественное мясное сырье: говядина жилованная высшего сорта, свинина жилованная нежирная, баранина жилованнаяодносортная, языки свиные и говяжьи и т.д. Внесение в них каких-либо наполнителей типа крахмала или соевых белковых препаратовне предусмотрено. В варёные колбасы 1-го и 2-го сортов и в некоторые низкосортные полукопчёные и ливерные колбасы и сардельки добавляют крахмал или пшеничную муку. Крахмал снижает пищевую ценность колбас, и по этому его количество не должно превышать 2-3%. Мука, крахмал - наполнители. Они устраняют бульонные отеки, придают монолитность и увеличивают выход, могут стать причиной резиноподобной консистенции, "пустого" вкуса. Определение крахмала в колбасных изделиях основано на окислении альдегидных групп моносахаридов, образующихся при гидролизе крахмала в кислой среде, двухвалентной медью реактива Фелинга с образованием осадка закиси меди. При гидролизе крахмала образуются редуцирующие сахара, основную массу которых составляет глюкоза.
(С6Н10О5)n + nH2O®n(C6H12O6)
Образовавшиеся при гидролизе крахмала редуцирующие сахара, благодаря наличию альдегидных групп, окисляются в щелочной среде реактивом Фелинга - растворимым комплексным соединением меди (II) с сегнетовой солью. При окислении глюкозы Сu (II) восстанавливается до закиси меди Сu2О.
Количество восстановленной меди соответствует разнице содержания окисной меди в холостом опыте и после кипячения с раствором инвертного сахара. Содержание общего и остаточного количества окисной меди определяется йодометрически с индикатором – крахмалом: I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Цель работы: определить массовую долю крахмала в различных пищевых добавках и мясных продуктах. Реактивы и оборудование: 1) технические весы; 2) электрическая плитка; 3) водяной или воздушный холодильник; 4) бюретка на 25 мл; 5) мерные колбы на 50, 100, 250 мл; 6) конические колбы на 100 и 250 мл; 7) пипетки на 2, 10 и 25 мл. 8) 10%-ный раствор соляной кислоты; 9) 10%-ный раствор гидроксида натрия; 10) 15%-ный раствор гексацианоферрата (II) калия; 11) 30%-ный раствор сульфата цинка; 12) диэтиловый эфир; 13) раствор Фелинга; 14) 30%-ный раствор иодида калия; 15) 25%-ный раствор серной кислоты; 16) 0,1 М раствор тиосульфата натрия; 17) раствор крахмала; 18) индикатор фенолфталеин.
Порядок выполнения работы Навеску образца продукта массой ~20 г, взвешенную с точностью до 0,01 г, помещают в круглодонную колбу на 250 мл и приливают небольшими порциями 80 мл раствора соляной кислоты при постоянном помешивании стеклянной палочкой. Колбу с содержимым присоединяют к обратному водяному или воздушному холодильнику, ставят на электроплитку, подложив под колбу асбестовую сетку, нагревают до кипения и 15 мин кипятят. Затем колбу охлаждают до комнатной температуры холодной водой и содержимое количественно переносят в мерную колбу на 250 мл и доводят объем жидкости в колбе до метки дистиллированной водой таким образом, чтобы попавший в колбу жир находился над меткой.После перемешивания содержимое колбы фильтруют через бумажный фильтр. Вносят пипеткой 25 мл фильтрата в мерную колбу на 50 мл, добавляют 1 каплю раствора индикатора фенолфталеина и нейтрализуют раствором гидроксида натрия до появления от одной капли щелочи красноватой окраски. Сразу же добавляют в колбу по каплям раствор соляной кислоты до исчезновения красноватой окраски и еще 2-3 капли этой же кислоты для установления слабокислой реакции раствора. Для осветления гидролизата и осаждения белков к раствору в колбе на 50 мл пипеткой добавляют 1,5 мл раствора гексацианоферрата калия (реактив КаррезаI) и 1,5 мл раствора сульфата цинка (реактив КаррезаII). Содержимое колбы охлаждают до комнатной температуры, доводят объем дистиллированной водой до метки, перемешивают и фильтруют через бумажный фильтр (в случае образования пены добавляют 1-2-капли серного эфира). В две мерные колбы на 100 мл добавляют: в одну - 10 мл прозрачного бесцветного фильтрата, в другую - 10 мл дистиллированной воды (для приготовления контрольного раствора). Затем в каждую колбу добавляют по 20 мл раствора Фелинга, полученного смешиванием (1:1) растворов Фелинга-1 и Фелинга-2. Содержимое колбы взбалтывают и кипятят на электроплитке 3 мин, считая с момента закипания. После кипячения колбы охлаждают холодной водой, доводят объемы дистиллированной водой до метки, тщательно перемешивают и дают осесть выпавшему оксиду меди. В коническую колбу вместимостью 100 мл пипеткой вносят 20 мл отстоявшейся жидкости, последовательно добавляют мерным цилиндром сначала 10 мл 30%-ного раствора йодистого калия, затем 10 мл 25%-ного раствора серной кислоты и сразу же титруют выделившийся йод раствором тиосульфата натрия до слабо-желтой окраски. Затем добавляют 1 мл раствора крахмала и продолжают медленно титровать (с промежутком между каплями 5-6 с) до полного исчезновения синей окраски раствора. Затем производят титрование контрольного раствора. Расчеты: 1) Объем 0,1 М раствора тиосульфата натрия Vx (в мл), пошедшего на титрование образующегося в ходе реакции йода, рассчитывают по формуле:
где К – коэффициент пересчета на точно 0,1 М раствор тиосульфата натрия; Vк, Vи – соответственно, объемы 0,1 М раствора тиосульфата натрия, израсходованного на титрование контрольного и испытуемого растворов, мл; 100 – разбавление гидролизата после кипячения, мл; 20 – объем титруемого раствора, мл. По таблице 1 находят массу крахмала (a, мг), соответствующую массе тиосульфата натрия (Na2S2O3), содержащегося в 1 мл 0,1 М раствора. 2) Рассчитывают массовую долю крахмала w (%) по формуле:
где a - масса крахмала, соответствующая массе тиосульфата натрия, содержащегося в 1 мл 0,1 М раствора (определяют по табл. 1), г; 250 – объем гидролизата, мл; 50 – разведение фильтрата после нейтрализации и осаждения белков, мл; m – масса навески образца, г; 25 – объем фильтрата, взятый для нейтрализации и осаждения белков, мл; 10 – объем гидролизата, взятый для кипячения, мл.
Таблица 1 Взаимосвязь массы крахмала, содержащегося в анализируемом продукте и объема раствора тиосульфата натрия, пошедшего на титрование
Расхождение между результатами параллельных определений не должно превышать 0,2%. За окончательный результат принимают среднее арифметическое результатов трех параллельных определений. Вычисление производят с точностью до 0,1%. После выполнения работы и расчетов студенты делают заключение о соответствии продукта требованиям государственного стандарта по массовой доле крахмала в анализируемом продукте. Примечание. При вычислении содержания крахмала в ливерной яичной колбасе найденный процент умножают на 0,7 (поправочный коэффициент на содержание редуцирующих веществ в продукте). При анализе растительных добавок делают расчет количества добавки в фарше для получения качественной продукции, соответствующей государственному стандарту. Пример расчетов: на титрование 20 мл контрольного раствора израсходовано 3,21 мл 0,1 М раствора тиосульфата натрия (К = 0,9877), а на титрование 20 мл анализируемого раствора - 2,18 мл:
По таблице 1 находим массу крахмала, соответствующую 5,09 мл 0,1 М раствора тиосульфата натрия:
где 14,2 - масса крахмала, соответствующая 5 мл 0,1 М раствора Na2S2O3, мг; 2,9 - разность значений массы крахмала для 5 и 6 мл раствора Na2S2O3, мг; 0,261 - масса крахмала, соответствующая 0,09 мл 0,1 М раствора Na2S2O3, мг.
Таким образом, массовая доля крахмала в анализируемом продукте равна 3,62%. Контрольные вопросы
1. Какие добавки входят в группу веществ, изменяющих структуру и физико-химические свойства пищевых продуктов? Классификация. Примеры. 2. Какие основные виды модификаций крахмалов вы знаете? Как строение модифицированных крахмалов связано с особенностями их свойств? 3. Какую химическую реакцию проводят для получения из крахмала моносахаридов? Составьте уравнение реакции, назовите продукты реакции. 4. Напишите уравнение реакции окисления альдегидных групп моносахаридов. 5. Вещества, улучшающие внешний вид продуктов. Группы. Примеры. Значение. 6. Вещества, увеличивающие срок годности. Классификация. Примеры. Значение. 7. Вещества, влияющие на вкус аромат. Классификация. Примеры. Значение. 8. 8. БАД. Классификация. Примеры. Значение.
Список использованной литературы. 1. Руководство по методам анализа качества и безопасности пищевых продуктов / под ред. Скурихина И.М., Тутельяна В.А. – М.: Брандесс Медицина, 1998. – 342 с. 2. Химический состав российских пищевых продуктов: Справочные таблицы / под ред Скурихина И.М., Тутельяна В.А.– М.: ДеЛипринт, 2002. – 236 с. 3. Методические указания к выполнению лабораторных работ по курсу «Пищевая химия» (для студентов технологических специальностей) / под ред. А.П. Нечаева. – М.: Издательский комплекс МГАПП, 1994. – 38 с. 4. Кобелева И.Б., Вяльцева И.В., Фуголь О.А. Методические указания и контрольные задания по курсу «Пищевая химия» (для студентов заочной формы обучения). – М.: Издательский комплекс МГУПП, 1999. – 90 с.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра химии
ОПД. Ф. 10ХИМИЯ ПИЩИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к выполнению лабораторных работ
Направление подготовки дипломированного специалиста 655900 – Технология сырья и продуктов животного происхождения
Уфа 2012
Рекомендовано к изданию методической комиссией факультета пищевых технологий
(протокол № от «____» __________ 2012 г.)
Составитель: Чернышенко Ю.Н.
Ответственный за выпуск: заведующий кафедрой химии Исламова Р.М.
Оглавление
ВВЕДЕНИЕ
Методические указания к лабораторным работам по дисциплине «Химия пищи» предназначены для студентов факультета пищевых технологий и составлены в соответствии с программой подготовки дипломированного специалиста по направлению 655900 - Технология сырья и продуктов животного происхождения. Каждая лабораторная работа выполняется студентами индивидуально и проводится в течение 4-х часов в следующей последовательности: 1) студент дома самостоятельно знакомится с целью работы, изучает методическое указание и соответствующую учебную литературу, оформляет описательную часть отчета; 2) на занятии студент получает задание у преподавателя и приступает к выполнению работы; 3) после завершения работы студент приводит рабочее место в порядок, делает необходимые расчеты, заканчивает оформление отчета и сдает его преподавателю. Работа считается выполненной студентом только тогда, когда отчет со всеми результатами и сделанными на основании их выводами принят преподавателем. Предлагаемые методические указания составлены на основе опыта проведения лабораторных занятий на кафедре химии Башкирского государственного аграрного университета.
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ И ТЕХНИКА БЕЗОПАСНОСТИ 1. Перед каждой лабораторной работой следует изучить относящийся к ней теоретический материал. Только тогда лабораторные занятия будут полезными и продуктивными. 2. Начинать опыты следует только после внимательного ознакомления с описанием работы и уяснив технику ее выполнения. 3. Не брать реактивы в большем количестве, чем требуется для проведения опыта. 4. Неизрасходованные или взятые в избытке реактивы не рекомендуется сливать обратно в бутыли или другую тару; их необходимо сдавать лаборанту. 5. Не загромождать рабочее место посторонними предметами или реагентами. 6. Не уносить приборы и аппараты, а также реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место сразу после его использования. 7. Все работы с вредными веществами проводить только под вытяжным шкафом. Нельзя переносить концентрированные кислоты и щелочи с одного места на другое. 8. Не путать пробки от склянок, а также пипетки для отбора жидких реактивов. 9. Горячие приборы и посуду ставить только на специальные подставки, а не на стол. 10. По окончании работы необходимо вымыть химическую посуду, тщательно убрать рабочее место, отключить воду и электричество. 11. Обязательно вести запись результатов, проведенных лабораторных работ. Пока в тетрадь не занесены результаты предыдущего опыта, не переходить к следующему. 12. При нагревании пробирок и колб с их содержимым во избежание выброса жидкости нельзя направлять их отверстием к себе или в сторону соседа. 13. Если на кожу попала концентрированная кислота, то пораженное место следует тотчас же промыть обильным количеством воды под краном, после чего обработать 5%-ным раствором соды. 14. В случае попадания концентрированной щелочи пораженное место следует промыть водой, затем разбавленным раствором уксусной кислоты. 15. При получении ожогов от прикосновения к горячим предметам надо обожженное место покрыть марлей, пропитанной 2%-ным раствором перманганата калия или 3%-ным раствором танина. 16. При порезах рук стеклом следует в первую очередь удалить из раны осколки стекла, затем смыть кровь 2%-ным раствором перманганата калия или спиртом и, смазав рану йодной настойкой, забинтовать. 17. Испытывать газы на запах нужно осторожно: пробирку следует держать в полувытянутой левой руке так, чтобы отверстие находилось ниже уровня носа, и правой рукой направлять к себе слабый ток воздуха. 18. Огнеопасные вещества, такие, как водород, бензин, эфир, надо держать подальше от источника открытого огня.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 456; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.194.29 (0.016 с.) |




 L =а-в (смотри рисунок),
L0 =а-б (смотри рисунок).
Рисунок 1. Хроматограмма. Линия а-а – линия старта, б-б – линия фронта растворителя (линия финиша), в – линии, отвечающие центру пятен вещества.
А –точка нанесения раствора глюкозы;
Б – точка нанесения раствора гидролизата;
В – точка нанесения раствора мальтозы.
L =а-в (смотри рисунок),
L0 =а-б (смотри рисунок).
Рисунок 1. Хроматограмма. Линия а-а – линия старта, б-б – линия фронта растворителя (линия финиша), в – линии, отвечающие центру пятен вещества.
А –точка нанесения раствора глюкозы;
Б – точка нанесения раствора гидролизата;
В – точка нанесения раствора мальтозы.
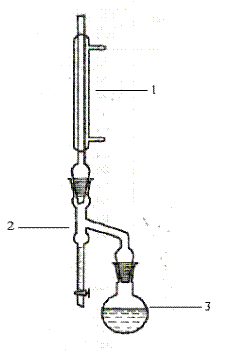 Рис.3. Прибор для азеотропной
отгонки воды.
1 – холодильник,
2 – приемник Дина-Старка,
3 – отгонная колба.
Рис.3. Прибор для азеотропной
отгонки воды.
1 – холодильник,
2 – приемник Дина-Старка,
3 – отгонная колба.
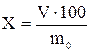 ,
где V – объем воды в приемнике, мл;
m0 – масса навески, г.
,
где V – объем воды в приемнике, мл;
m0 – масса навески, г.
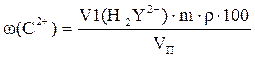

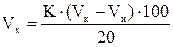 ,
,
 ,
, = 0,9877×(3,21-2,18)×5 = 5,09 мл
= 0,9877×(3,21-2,18)×5 = 5,09 мл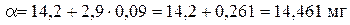 ,
, = 0,014461×250 = 3,62%
= 0,014461×250 = 3,62%


