
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение азота в органических соединениях (метод кьельдаля).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Титрант: раствор хлороводородной кислоты. Индикатор: метиловый красный в смеси с метиленовым синим.
Варианты
6.1. Классический метод Кьельдаля (см. часть 1, «Ковалентно связанный азот», количественное определение, п. 1).
Примеры лекарственных веществ: Примидон (ФС) Осадмид (ФС) Гексамидин (ФС)Оксафенамид (ФС)Дипрофиллин (ФС)
f экв = 1/2 f экв = 1 f экв = 1/4 ЛВ ЛВ ЛВ
6.2. Видоизмененный метод Кьельдаля – основан на гидролитическом разложении лекарственных веществ по амидным группам:
Фактор эквивалентности зависит от числа амидных групп.
6.2.1. Гидролитическое разложение амидов в присутствии натрия гидроксида и дальнейшее определение образовавшегося аммиака по методу Кьельдаля (пирацетам (ноотропил) – ФС) Метод основан на свойстве вещества гидролизоваться под действием натрия гидроксида с выделением аммиака. Определение проводят в установке Кьельдаля. Аммиак отгоняют и улавливают раствором борной кислоты, отгон титруют раствором хлороводородной кислоты по смешанному индикатору (метиловый красный в смеси с метиленовым синим).
f экв = 1 т.к. из 1 молек. вещества ® 1 молек. NH3 ® 1 молек. HCl 6.2.2. Гидролитическое разложение амидов в присутствии серной кислоты с образованием соли амина, которую разлагают щелочью до летучего амина и далее определяют по методу Кьельдаля (никетамид или диэтиламид никотиновой кислоты – неоф. метод).
f экв вещ. = 1
Видоизмененный метод Кьельдаля используется для определения салициламида (ФС), можно по этому методу определить никотинамид (неоф. метод).
7. Комплексонометрия – метод основан на свойстве катионов металлов количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде бесцветных внутрикомплексных соединений. Титрант: раствор трилона Б – динатриевая соль этилендиаминтетрауксусной кислоты (сокращенно (Na2H2TrБ). Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Действие металлоиндикаторов зависит от pH среды: а) pH 9,5-10 создается аммиачным буфером. Индикаторы: кислотный хром черный специальный (или эриохром черный Т), кислотный хромовый темно-синий (или хромовый темно-синий), переход окраски от красно-фиолетовой или вишнево красной к синей или сине-фиолетовой. Титруют: Zn2+, Mg2+, Ca2+. б) pH 1-2 создается добавлением разведенной азотной кислоты; pH 4-5-6 создается добавлением ацетатного буферного раствора; pH 7,8-8,2 создается добавлением гексаметилентетрамина (метенамина). Индикатор: ксиленоловый оранжевый, переход окраски от красной к желтой. Титруют: Bi3+ (pH 1-2); Cu2+ (pH 4-5-6); Zn2+, Pb2+, Al3+ (pH 7,8-8,2). в) pH 12-14 создается 30% раствором натрия гидроксида вблизи точки эквивалентности. Индикатор: кальконкарбоновая кислота, переход окраски от красновато-сиреневой к голубой. Титруют: Ca2+.
Варианты
7.1. Прямого титрования. Определяют цинка сульфат, кальция хлорид, магния сульфат, цинка оксид, магния оксид, кальция лактат, кальция глюконат, висмута нитрат основной (ФС). Реакция комплексообразования идет быстро. 1) Ca2+ + H2Ind ® CaInd + 2 H+
2)
3) в точке эквивалентности: CaInd + Na2H2TrБ ® CaNa2TrБ + H2Ind Окраска раствора за счет свободного индикатора
7.2. Обратного титрования. Используется, если: - реакция комплексообразования проходит медленно (Al3+); - нет подходящего индикатора (Pb2+); - анализируемое вещество не растворяется в воде
1) Pb2+ + Na2H2TrБ ® PbNa2TrБ + 2 H+ изб. количество pH 9,5-10 2) Na2H2TrБ + ZnSO4 ® ZnNa2TrБ + (NH4)2SO4 + 2 H2O (NH4OH, NH4Cl) в точке эквивалентности: H2Ind + Zn2+ ® ZnInd + 2 H+ окраска раствора за счет комплекса металла с индикатором
Трилон Б образует с катионами металлов комплексонаты в стехиометрическом соотношении 1:1 независимо от заряда катиона, поэтому f экв = 1. Исключение составляет препарат – висмута нитрат основной, т.к. это вещество непостоянного состава и расчет идет на Bi2O3, поэтому f экв Bi2O3 = 1/2.
7.3. Косвенного титрования. Основан на свойстве органических лекарственных веществ с третичной аминогруппой (папаверина гидрохлорид, морфина гидрохлорид, атропина сульфат, хлорпромазина гидрохлорид (аминазин), хинина гидрохлорид и др.) образовывать комплексные соли с общеалкалоидными реактивами, например, тетрароданоцинкатом аммония, калия тетрайодовисмутатом (III) (неоф. метод) (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 5).
Примеры лекарственных веществ:
Хлорпромазина гидрохлорид (Аминазин), Атропина сульфат f экв = 2/n = 2/1 = 2 f экв = 2/n = 2/2 = 1
8. ЦЕРИМЕТРИЯ (окислительно-восстановительное титрование). Титрант: раствор церия (IV) сульфата. Индикация: 1) безиндикаторный; 2) дифениламин или ферроин - комплекс Fe (II) с о-фенантролином; 3) потенциометрический способ индикации.
Метод основан на свойстве препаратов окисляться солями церия (IV), которые в кислой среде восстанавливаются до церия (III). +1ē Ce4+ ® Ce3+
Варианты Прямого титрования.
8.1.1. Хлорпромазина гидрохлорид (Аминазин) (МФ II) (безиндикаторный метод) – окисление за счет серы до моносульфоксида.
f экв = 1/2 Титруют до исчезновения образующегося в процессе титрования красного окрашивания.
8.1.2. Менадиона натрия бисульфит (викасол) (ФС) (в присутствии индикатора – ферроина). Метод основан на окислении восстановленной формы менадиона сульфатом церия (IV) до 2-метил-1,4-нафтохинона и восстановлении церия (IV) до церия (III). Предварительно действием щелочи выделяют 2-метил-1,4-нафтохинон, извлекают хлороформом, хлороформ отгоняют, менадион восстанавливают цинковой пылью в кислой среде до 2-метил-1,4-дигидроксинафталина, который окисляют сульфатом церия (IV).
f экв = 1/2 В точке эквивалентности избыточная капля титранта (Ce(SO4)2 окисляет Fe2+ в составе комплекса с- фенантролином до Fe3+, который с о-фенантролином дает комплекс голубого цвета. Титруют до зеленого окрашивания (голубой цвет комплекса с желтым раствором титранта (Ce(SO4)2)дает зеленую окраску).
красный голубой 8.1.3. Аскорбиновая кислота (неоф. метод) (в присутствии индикатора – ферроина).
f экв = 1/2 дегидроаскорбиновая кислота
8.1.4. Нифедипин (ФС для субстанции) (в присутствии индикатора – ферроина). Метод основан на окислении нифедипина сульфатом церия (IV) и восстановлении церия (IV) до церия (III).
f экв = 1/2
8.1.5. Токоферола ацетат в 50% масляном растворе (ФС) после кислотного гидролиза (индикатор – дифениламин).
f экв = 1/2
В точке эквивалентности появляется сине-фиолетовое окрашивание:
дифениламин иммониевая соль дифенилбензидина 8.2. Обратного титрования. Избыток церия (IV) сульфата (титранта) определяют йодометрически. 8.2.1. Гидрохлоротиазид (дихлотиазид) (ФС), метамизол-натрий (анальгин) (неоф. метод), фенилбутазон (бутадион) (неоф. метод)
f экв = 1/2
2Ce(SO4)2 + 2 KI ® I2 + Ce2(SO4)3 + K2SO4 остаток I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6;
8.2.2. Кофеин (теобромин, теофиллин) (неоф. метод). Избыток титрованного раствора церия (IV) сульфата при нагревании окисляет вещества в кислой среде до образования аллоксанов (1,3-диметилаллоксан образуется при окислении кофеина и теофиллина, 3-метилаллоксан – при окислении теобромина).
f экв = 1/4 Избыток церия (IV) сульфата определяют йодометрически (см. п. 8.2.1.).
БРОМАТОМЕТРИЯ. Титранты: растворы калия бромата и натрия тиосульфата. Вспомогательные растворы – калия бромида и калия йодида. Индикация: 1) раствор крахмала, 2) метиловый оранжевый, 3) без индикатора, 4) хлороформ (экстракционный способ).
Варианты
9.1. Замещения – основан на свойстве лекарственных веществ - фенолов и ароматических аминов вступать в реакцию электрофильного замещения атомов водорода ароматического кольца на атомы брома.
9.1.1. Прямого титрования: Тимол (ФС), прокаина гидрохлорид (новокаин), бензокаин (анестезин), сульфаниламид (стрептоцид) и другие производные п-аминобензойной кислоты и сульфаниламидов (неоф. методы).
9.1.1.1. Тимол (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.1.).
9.1.1.2. Сульфаниламид (Стрептоцид) (неоф. метод). KBrO3 + 5 KBr + 6 HCl ® 3 Br2 + 6 KCl + 3 H2O
f экв = 1/4
9.1.2. Обратного титрования. Избыток брома определяют йодометрическим методом. Фенолопроизводные (фенол, резорцин (ФС)), салициловая кислота (с декарбоксилированием), натрия салицилат, фенилсалицилат (после гидролиза) (неоф. методы), раствор гексэстрола (синэстрола) в масле 2% для инъекций (ФС), производные урацила (неоф. методы).
9.1.2.1. Резорцин (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.2.).
9.1.2.2. Тегафур (фторафур) (неоф. метод).
Br2 + 2 KI ® I2 + 2 KBr остаток I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 f экв = 1/2
9.1.2.3. Хинозол (неоф. метод):
f экв = 1/8 Вариант обратного титрования.
9.1.2.4. Салициловая кислота (неоф. метод) (с декарбоксилированием). Можно определить сложные эфиры и амиды (фенилсалицилат, ацетилсалициловую кислоту, салициламид) после гидролиза (неоф. метод).
f экв = 1/6 Вариант обратного титрования.
9.1.2.5. Гексэстрол (синэстрол) (масляный 2% р-р для инъекций - ФС).
f экв = 1/8 Вариант обратного титрования.
Окислительного титрования.
9.2.1. Для экспресс-анализа йодсодержащих лекарственных веществ – основан на окислении йодид-иона (I-) до йодмонохлорида (ICl) броматом калия в сильно кислой среде HCl (1:1).
Титрант: раствор калия бромата. Индикация: 1)метиловый оранжевый (переход окраски от красно-бурой до лимонно-желтой); 2) безиндикаторный способ (переход окраски от бурой в лимонно-желтую).
9.2.1.1. Прямого титрования. Калия йодид (неоф. метод). 6 KI + KBrO3 + 6 HCl ® 3 I2 + KBr + 6 KCl + 3 H2O
6 KI + 2 KBrO3 + 12 HCl ® 6 ICl + 2 KBr + 6 KCl + 3 H2O или 2 KI + KBrO3 + 6 HCl ® 3 ICl + KBr + 3 KCl + 3 H2O f эквKI = 1/2
Косвенного титрования. Тиамина бромид (неоф. метод) – при взаимодействии с реактивом Драгендорфа образуется комплексное соединение, после растворения осадка в растворе хлороводородной кислоты образующиеся йодид-ионы косвенно определяют броматометрическим методом окислительного титрования. Метод разработан на кафедре фармхимии ПГФА доцентом Г.И. Савельевой. Предложен для анализа тиамина в многокомпонентных лекарственных препаратах, при малом содержании тиамина, когда другие титриметрические методы использовать невозможно.
Тиамин осаждают реактивом Драгендорфа. [T+]Br- × HBr + 2 KBiI4 ® [T+] × [BiI4-] × HBiI4¯ + 2 KBr; 1 моль 1 моль Осадок отфильтровывают, промывают от избытка реактива, затем растворяют в растворе HCl: Осадок + 8 HCl ® 8 HI + [T+]Cl- × HCl + 2 BiCl3; 18-20% 8 молекул 3 HI + KBrO3 + 3 HCl ® 3 ICl + KBr + 3 H2O -2ē I- ® I+ В ходе реакции образуется 8 I- - ионов, следовательно, f эквтиам. = 1/16.
10. Меркуриметрия – метод основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (II). Прямое титрование. Титранты: легко ионизированные соли ртути (II) – ртути (II) нитрат; ртути (II) перхлорат.
10.1. Определение галогенидов. 2 MeX + Hg+2(NO3)2 ® HgX2 + 2 MeNO3 , f экв = 1 где Х – Cl-, Br-, I-. Титрование в азотнокислой среде. Индикация: дифенилкарбазон.
светло-сиреневое окрашивание
10.1.1. Хлориды и бромиды калия и натрия, кальция хлорид (неоф. метод). 2 NaBr + Hg(NO3)2 ® HgBr2 + 2 NaNO3 f экв = 1 CaCl2 + Hg(NO3)2 ® Ca(NO3)2 + HgCl2 f экв = 1/2
10.1.2. Йодиды натрия и калия (неоф. метод). Варианты 10.1.2.1. Безосадочный в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов. Титрант: ртути (II) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2] 2 KI + Hg(ClO4)2 ® HgI2¯ + 2 KClO4 спирт: вода (1:1) f экв = 1
10.1.2.2. Осадочного титрования с йодкрахмальным способом фиксации точки эквивалентности, индикация как в методе Кольтгофа.
KIO3 + 5 KI + 3 H2SO4 ® 3 I2 + 3 K2SO4 + 3 H2O I2 + I- ® [I3]- + крахмал ® синее окрашивание. В точке эквивалентности из раствора исчезают йодиды, что сопровождается исчезновением синего окрашивания:
2 I- + Hg(NO3)2 ® HgI2¯ + 2 NO3- или Hg(ClO4)2 или 2 ClO4- f экв = 1 10.2. Определение гидрохлоридов и гидробромидов органических оснований: Тиамина хлорид или бромид; папаверина, этилморфина, эфедрина, пиридоксина, пилокарпина гидрохлориды; скополамина гидробромид и др. (неоф. методы). 2 R º N × HX + Hg(NO3)2 ® 2 R º N × HNO3 + HgX2 f экв = 1/n где n – число молекул HBr или HCl в молекуле анализируемого препарата.
10.2.1. Скополамина гидробромид (неоф. метод).
(индикатор – дифенилкарбазон) f экв = 1
10.2.2. Тиамина бромид или хлорид (неоф. метод). (HNO3) [T+]Br- × HBr + Hg(NO3)2 ® [T+]NO3- × HNO3 + HgBr2 1 молекул (индикатор – дифенилкарбазон) f экв = 1/2 10.3. Определение лекарственных веществ, содержащих ковалентно связанный хлор и бром – основано на предварительном разрушении органического вещества сожжением в колбе с кислородом, растворении продуктов сгорания в поглощающей жидкости (раствор пероксида водорода) и последующим определении элементов в ионном виде. 10.3.1. Нозепам (по хлору) (неоф. метод). (см. п. 12.1).
(HNO3) 2 Cl- + Hg(NO3)2 ® HgCl2 + 2 NO3- Индикатор - дифенилкарбазон f эквхлора = 1
11. АРГЕНТОМЕТРИЯ – метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом в виде галогенидов серебра.
Варианты
11.1. Мора (прямое титрование) – используется для титрования хлоридов или бромидов. Титрант: раствор серебра нитрата. Индикатор: калия хромат. Йодиды не определяют, т.к. (ПР AgI = 1,5 × 10-16; ПР AgCl = 1,8 × 10-10; Кроме того осадки серебра йодида и серебра хромата близки по цвету, что затрудняет определения точки эквивалентности. Реакция среды нейтральная или слабощелочная.
11.1.1. Натрия и калия хлориды и бромиды (ФС); кальция хлорид (неоф. метод). NaCl + AgNO3 ® AgCl¯ + NaNO3 2 AgNO3 + K2CrO4 ® Ag2CrO4¯ + 2 KNO3 красноватый осадок f экв = 1
11.1.2. Гидрохлориды и гидробромиды органических оснований - папаверина гидрохлорид, прокаина гидрохлорид (новокаин) (неоф. метод) и др.
2 AgNO3 + K2CrO4 ® Ag2CrO4¯ + 2 KNO3 f экв = 1
Фаянса (прямое титрование). Титрант: раствор серебра нитрата. Индикаторы: адсорбционные – натрия эозинат (для йодидов), бромфеноловый синий, флуоресцеин (для хлоридов и бромидов). Среда – уксуснокислая (разб. CH3cooh). Натрия эозинат не используется для определения хлоридов, т.к. анион в самом начале титрования вытесняет хлориды из осадка и розовая окраска наступает от первой капли титрованного раствора.
11.2.1. Калия и натрия йодиды (ФС), калия и натрия хлориды и бромиды (неоф. метод). а) HInd + H2O «Ind- + H3O+ эозинат натрия б) NaI + AgNO3 ® AgI¯ + NaNO3 в) Ind- + AgI¯ + AgNO3 (изб. капля) ® [(AgI)Ag+]Ind-¯ + NO3- f экв = 1 11.2.2. Гидрохлориды, гидробромиды, гидройодиды органических оснований (эфедрина гидрохлорид, бендазола гидрохлорид (дибазол), дифенгидрамина гидрохлорид (димедрол), этилморфина гидрохлорид, пахикарпина гидрохлорид (неоф. метод)).
f экв = 1
11.2.3. Лекарственные вещества, содержащие ковалентно-связанный галоген после переведения его в ионогенное состояние (гидролитическое разложение, восстановительная минерализация). Кислота йопаноевая (неоф. метод).
1 моль 3 моль 3 NaI + 3 AgNO3 ® 3 AgI¯ + 3 NaNO3 f экв = 1/n, где n- число атомов галогена в органическом соединении; для йопаноевой кислоты f экв = 1/3.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 2505; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.009 с.) |







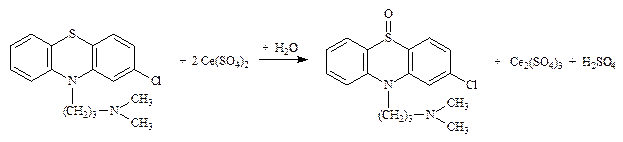









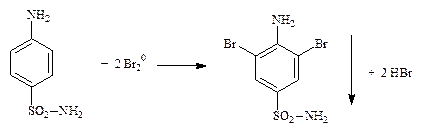




 3 I2 + KBrO3 + 6 HCl ® 6 ICl + KBr + 3 H2O
3 I2 + KBrO3 + 6 HCl ® 6 ICl + KBr + 3 H2O








