
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2.3 Изучение кинетики взаимодействия иодат-ионовСодержание книги
Поиск на нашем сайте
С сульфит-ионами Механизм реакции взаимодействия иодат-ионов с сульфит-ионами можно представить следующим образом: Первая стадия: IO3– + SO32– + 4Н+→ I– + SO42– + 2Н2О Вторая стадия: 5I– + 6Н+ + IO3– → 3I2 + 3Н2О Вторая стадия наступает после того, как все ионы SO32– окажутся израсходованными, а в растворе имеется еще избыток ионов IO3–. Если в раствор добавить крахмал, то при появлении в растворе молекулярного йода, последний, соединяясь с крахмалом, образует комплекс синего цвета. Так что появление синей окраски указывает на то, что реакция дошла до конца. До этого момента I2 также может образовываться и реагировать с крахмалом, однако он одновременно вступает в реакцию с SO32–: SO32– + I2 + Н2О → 2I– + SO42– + 2Н+ Йод начинает накапливаться в ощутимых количествах тогда, когда сульфит-ионы будут полностью израсходованы. В этот момент раствор окрасится в синий цвет. Кинетическое уравнение скорости реакции имеет вид:
В настоящей работе предлагается найти величину порядка реакции по сульфит-иону (у). С этой целью необходимо создать условия, при которых концентрация иодат-ионов будет намного больше концентрации сульфит-ионов, например, в 10–20 раз. Тогда в конце опыта концентрация иодат-ионов изменится незначительно по сравнению с концентрацией сульфит-ионов, то есть можно считать ее постоянной. Следовательно, для скорости реакции справедливо выражение:
из которого определяют порядок реакции (у). Реакцию проводят при наличии избытка кислоты, так что концентрацию ионов водорода можно считать постоянной. Реактивы: 0,02М раствор КIO3 (готовится из расчета 4,3 г КIO3 на 1 л раствора), 0,001М раствор Na2SO3 (содержит 5 мл раствора крахмала, 2 мл 1М раствора H2SO4, 0,1 г С6Н4(ОН)СООН, 0,04 г Na2SO3, 1 мл С2Н5ОН в расчете на 200 мл раствора). Принадлежности к работе: 2 мерные пробирки на 10 мл, 5 стаканов на 50 мл, секундомер. Выполнение работы: приготовить растворы с различной концентрацией Na2SO3, разбавляя исходный раствор сульфита натрия следующим образом:
Расчет концентрации сульфита натрия проводился с учетом разбавления его водой и смешивания в равных объемах с раствором иодата натрия. При проведении опыта к каждому из приготовленных растворов Na2SO3 прилить 10 мл раствора КIO3 (не одновременно, а по мере завершения очередного опыта). Включить секундомер и записать время появления синей окраски.
Обработка экспериментальных данных: в соответствии с указаниями в п. 1.4 провести расчеты по первому способу. Если окажется, что ни одна из рассмотренных зависимостей не является линейной, то для определения порядка реакции используют второй способ, изложенный там же.
Опыт 2.4 Изучение кинетики взаимодействия тиосульфата Натрия с серной кислотой
Реакция взаимодействия тиосульфата натрия с серной кислотой является сложной. Ниже приведены уравнения постадийных реакций и суммарное уравнение реакции: Na2S2O3 + H2SO4 → H2S2O3 + Na2SO4, (a) H2S2O3 → H2SO3 + S, (б) H2SO3 → SO2 + H2O, (в)
Na2S2O3 + H2SO4 → Na2SO4+ S + SO2 + H2O Реакции (а) и (в) протекают почти мгновенно, а скорость всего процесса фактически определяется скоростью реакции (б), в результате протекания которой выделяется коллоидная сера. Кинетическое уравнение скорости имеет вид: W = k∙[H2SO4]х∙[Na2S2O3]y. Целью данной работы является нахождение порядка реакции по H2SO4 и порядка реакции по Na2S2O3. Исследования проводятся в два этапа. Этап 1. Нахождение порядка реакции по H2SO4 Готовят несколько растворов с различной концентрацией серной кислоты и столько же растворов с тиосульфатом натрия, но постоянной концентрации. Причем концентрацию Na2S2O3 берут в большем избытке (в 10–20 раз) больше. Таким образом, концентрация тиосульфата натрия в конце опыта изменится незначительно по сравнению с концентрацией серной кислоты. В этом случае для скорости реакции справедливо будет выражение
из которого находят порядок реакции по H2SO4 (x). Этап 2. Нахождение порядка реакции по Na2S2O3 Готовят несколько растворов с различной концентрацией Na2S2O3 и постоянной, но в 10–20 раз большей концентрацией H2SO4. Тогда скорость реакции может быть описана уравнением:
из которого находят порядок реакции по Na2S2O3 (у). Принадлежности к работе: семь мерных пробирок с меткой маркером, секундомер, стеклянная палочка. Реактивы: В таблице 3 приведены концентрации рабочих растворов, используемых для выполнения первого и второго этапов исследований (выдаются инженером), а в таблице 4 – концентрации серной кислоты и тиосульфата натрия сразу после смешивания.
Таблица 3 – Составы рабочих растворов
Таблица 4 – Составы растворов сразу после смешивания (начало реакции)
Расчет концентраций серной кислоты и тиосульфата натрия сразу после смешивания производился при условии, что объем каждого из растворов, взятого для проведения опыта, одинаковый. Выполнение работы: 5 мл серной кислоты быстро вливают в пробирку, содержащую 5 мл тиосульфата натрия и тотчас начинают отсчет времени по секундомеру (реакционную смесь осторожно, без разбрызгивания размешать стеклянной палочкой). Наблюдают за выпадением серы. Опыт считается законченным по достижении одной и той же плотности серы. Каждый опыт повторяют 2–3 раза. Для определения плотности суспензии серы используют визуальный контроль: на пробирку, в которую наливают раствор, наносят маркером узкую цветную полоску. В начале опыта полоска хорошо просматривается через прозрачный раствор. После добавления второго реагента и начала образования суспензии раствор становится мутным и цветная полоска будет почти невидимой. Время от момента сливания растворов тиосульфата натрия и серной кислоты до полного исчезновения полоски записать. Обработка экспериментальных данных: время протекания реакции определяют как среднее арифметическое из двух-трех повторных опытов (если разброс значений невелик). При большом разбросе значений проводят дополнительные опыты, и аномальные результаты отбрасывают. Обработку результатов проводят в соответствии с правилами, изложенными в п. 1.4. 3 Методические рекомендации по оформлению отчета по лабораторной Работе
Отчет о работе должен содержать следующие разделы: – цель работы; – приборы и реактивы; – ход работы (должен включать основные моменты проведения эксперимента); – обработка экспериментальных данных (необходимо построить графики в соответствующих системах координат); – выводы по проделанной работе (проанализировав графики, определить порядок реакции по веществу и константу скорости). Отчет о работе должен быть написан кратко, четко, содержать только выводы по теме лабораторной работы. Отчет должен быть выполнен аккуратно и представлен на проверку в срок.
4 КоНтрольные вопросы 1. Что называется скоростью химической реакции? 2. Что такое элементарный акт реакции? 3. Что такое фаза химической системы? Как называются системы, которые состоят: а) из одной фазы; б) из двух или нескольких фаз? 4. Какие реакции называются: а) гомогенными; б) гетерогенными? 5. Что называется скоростью гомогенной реакции? Чему равна скорость гомогенной реакции? 6. Что называется скоростью гетерогенной реакции? 7. Какую зависимость дает закон действия масс? Сформулируйте его и дайте математическую запись закона для конкретных реакций: а) реакции синтеза аммиака, б) реакции окисления оксида серы (IV) в оксид серы (VI).
8. Чему равна константа скорости реакции? 9. Что называется общим и частным порядком реакции? 10. Что такое молекулярность реакции? 11. Как зависит скорость химических реакций от температуры? Дайте понятия энергии активации и активных молекул. 12. Для чего необходима энергия активации? Какие молекулы называются активными? 13. Что такое катализ? В чем заключается суть действия катализатора? Дайте понятие гомогенного и гетерогенного катализа. 14. Как называются вещества, которые замедляют химические реакции? 15. Что такое ферменты (энзимы)? Задачи Решение типовых задач
Пример 1. Напишите выражение зависимости скорости прямой и обратной реакций от концентрации реагирующих веществ для следующих процессов: а) 2SO3 (г) D 2SO2 (г) + О2 (г), б) FeO (тв) + СО (г) D Fe (тв) + СО2 (г). Как изменится скорость прямой и обратной реакций, если увеличить давление в системе в 3 раза? Решение а) Система гомогенная, тогда υпр = kпр∙[SO3]2, υобр = kобр∙[SO2]2∙[O2]. При увеличении давления в 3 раза концентрации веществ также увеличиваются в 3 раза. Тогда скорость прямой реакции υпр = kпр∙[3∙SO3]2 возрастет в 9 раз, а обратной – υобр = kобр∙[3∙SO2]2∙[3∙O2] возрастет в 27 раз. б) Система гетерогенная, тогда υпр = kпр∙[СО], υобр = kобр∙[СO2]. При увеличении давления в 3 раза скорость прямой реакции υпр = kпр∙[3∙СО] увеличится в 3 раза, а также обратной – υобр = kобр∙[3∙СO2] – в 3 раза. Пример 2. Определите порядок и молекулярность реакции. Напишите выражение для определения скорости реакции: а) Н2О2 (ж) → О2 (г) + 2Н (г), 6) S (тв) + O2 (г) → SO2 (г). Решение Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении: а) υ1 = k1∙[Н2О2]; б) υ2 = k2∙[O2]. Поэтому обе реакции первого порядка. Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция а) одномолекулярная, б) двухмолекулярная. Выражение для определения скорости реакции первого порядка:
Скорость реакции второго порядка для двух реагентов В и D подчиняется кинетическому уравнению:
где СB – концентрация реагента В, а СD – концентрация реагента D. Наиболее часто встречаются реакции первого и второго порядков. Реакции третьего порядка крайне редки. Реакции более высокого порядка, чем третий, неизвестны, так как в большинстве случаев реакции многостадийны.
Пример 3. При 80 °С некоторая реакция заканчивается за 16 минут. Сколько потребуется времени для проведения той же реакции: а) при 120 °С, б) при 60 °С? Температурный коэффициент реакции γ = 2. Решение а) Таким образом, скорость реакции при повышении температуры от 80 °С до 120 °С возрастает в 16 раз, а, следовательно, для проведения реакции потребуется в 16 раз меньше времени, то есть 1 минута. б) То есть скорость реакции при понижении температуры от 80 °С до 60 °С уменьшится в 4 раза, а времени потребуется для проведения данной реакции в 4 раза больше – 64 минут.
Задачи
1. Напишите выражение зависимости скорости прямой и обратной реакции от концентрации реагирующих веществ для следующих процессов (таблица 5). Как изменятся скорости прямой и обратной реакций, если увеличить давление в системе в 2 раза?
Таблица 5 – Данные для решения задачи
Продолжение таблицы 5
2. Определите порядок и молекулярность реакции. Напишите выражение для определения скорости реакции (таблица 6).
Таблица 6 – Данные для решения задачи
3. Реакция при температуре 50 °С протекает за 3 минуты. Температурный коэффициент скорости реакции равен 2. За какое время закончится эта реакция при t °С? (таблица 7)
Таблица 7 – Данные для решения задачи
4. Во сколько раз увеличится скорость химической реакции при повышении температуры от t1 до t2, если γ имеет определенное значение (таблица 8)?
Таблица 8 – Данные для решения задачи
5. Как изменится скорость реакции образования аммиака N2 + 3H2 → 2NH3, если увеличить давление в три раза? 6. Определите скорость химической реакции А + В → АВ, если начальная концентрация вещества А была равна 1М, а через 4 секунды концентрация этого вещества стала равна 0,6М. 7. Определите, как изменится скорость реакции 2SO2 (г) + О2 (г) → 2 SO3 (г) при: а) уменьшении концентрации исходных веществ в 2 раза; б) при увеличении давления в 3 раза. 8. Определите, как изменится скорость реакции СО2 (г) + С (тв) → 2 СО (г) при уменьшении давления в 4 раза. 9. Определите изменение скорости элементарных практически необратимых реакций, если увеличить в три раза давление в системе: a) 2NO (г) + С12 (г) → 2NOCl (г); б) 2СО (г) → СО2 (г) + С (к); в) N2O4 (г) → 2NO2 (г); г) 2NH3 (г) → 3Н2 (г) + N2 (г); д) 2NO2 (г) → N2O4 (г); e) СаО (к) + СО2 (г) → СаСО3 (к); ж) С (тв) + О2 (г) → СО2 (г); з) А2 (г) + 2В (г) → 2АВ (г); и) 2NO (г) + О2 (г) → 2NO2. 10. Во сколько раз уменьшится скорость прямой реакции 2СО (г) + О2 (г) D 2СО2 (г), если при постоянной температуре уменьшить давление газовой смеси в 4 раза? 11. Напишите выражение зависимости скорости химической реакции от концентрации реагирующих веществ для процессов: а) Н2 (г) + I2 (г) → 2HI (г); б) Ва2+ (р) + SO42– (p) → BaSO4↓; в) СаО (тв) + СО2 (г) → СаСО3 (тв). 12. Во сколько раз изменится скорость прямой и обратной реакции в системе, если объем газовой смеси уменьшить в 2 раза 2N2 (г) + 6Н2О (г) D 4NH3 (г) + 3О2 (г)? 13. Найти значение скорости реакции А + В → АВ, если при концентрациях веществ А и В, равных соответственно 0,05М и 0,01М, скорость реакции равна 5∙10–5 моль / (л∙мин). 14. Во сколько раз изменится скорость реакции 2А + В → А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? 15. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2 (г) + В2 → 2А2В (г), чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась? 16. В системе СО + Cl2 → COCl2 концентрацию СО увеличили от 0,03М до 0,12М, а концентрацию Cl2 – от 0,02М до 0,06М. Во сколько раз возросла скорость прямой реакции?
17. Во сколько раз увеличится скорость химической реакции, идущей при столкновении одной молекулы вещества А и двух молекул вещества В: А (г) + 2В (г) → С (г) + D (г) при увеличении концентрации вещества В в 3 раза? 18. Во сколько раз изменится скорость реакции 2А+В D А2В, если концентрацию вещества А увеличить в 3 раза, а концентрацию вещества В уменьшить в 3 раза? 19. Две реакции протекают с такой скоростью, что за единицу времени в первой образовался сероводород массой 6 г, во второй – иодоводород массой 20 г. Какая из реакций протекала с большей средней скоростью? 20. При повышении температуры на 10 °С скорость некоторой реакции возрастает в 3 раза. При температуре 0 °С скорость реакции составляет 1 моль/(л∙с). Вычислите скорость этой реакции при температуре 30 °С. 21. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 27 раз, если известно, что при увеличении температуры на 10 °С скорость реакции возрастает в 3 раза? 22. Во сколько раз увеличится скорость химической реакции при повышении температуры от 20 °С до 80 °С? Температурный коэффициент равен двум. 23. Рассчитайте, как изменится скорость реакции, температурный коэффициент которой равен 2,при: а) повышении температуры на 30 °С; б) понижении температуры от 70 °С до 20 °С. 24. На сколько градусов нужно понизить температуру для уменьшения скорости реакции в 27 раз, если ее температурный коэффициент равен 3? 25. Чему равен температурный коэффициент реакции, если при повышении температуры на 40 °С ее скорость увеличивается в 236 раз? 26. Во сколько раз увеличится скорость химической реакции Н2 (г) + I2 (г) → 2HI (г) при повышении температуры от 20 до 170 °С, если было установлено, что при повышении температуры на каждые 25 °С скорость реакции увеличивается в 3 раза? 27. Скорость некоторой реакции увеличивается в 2,5 раза при повышении температуры на 10 К. Во сколько раз увеличится скорость при повышении температуры от 10 до 55 °С? 28. Реакция при температуре 40 °С протекает за 180 секунд. Температурный коэффициент реакции равен 3. За сколько времени завершится эта реакция при 60 °С? 29. При 20 °С реакция протекает 2 мин. За сколько времени будет протекать эта реакция при 0 °С, если температурный коэффициент скорости реакции равен 2? 30. Во сколько раз увеличится скорость химической реакции О2 (г) + 2SO2 (г) → 2SO3 (г) при увеличении давления в системе в 4 раза и одновременном повышении температуры на 40 °C. Температурный коэффициент реакции равен 2.
Материалы и оборудование
1. 3 %-ный раствор пероксида водорода (H2O2). 2. диоксид марганца (MnO2). 3. 0,2 %-ный раствор иодида калия (KI). 4. 1М раствор серной кислоты (H2SO4). 5. 0,1М раствор тиосульфата натрия (Na2S2O3). 6. 1 %-ный раствор пероксида водорода (H2O2). 7. 0,05М раствор молибдата аммония ((NH4)2MoO4). 8. Свежеприготовленный раствор крахмала. 9. 0,02М раствор иодата калия (KIO3). 10. 0,001М раствор сульфита натрия (Na2SO3). 11. 1М раствор тиосульфата натрия (Na2S2O3). 12. 0,05М раствор тиосульфата натрия (Na2S2O3). 13. 0,025М раствор тиосульфата натрия (Na2S2O3). 14. 0,1М раствор серной кислоты (H2SO4). 15. 0,05М раствор серной кислоты (H2SO4). 16. 0,025М раствор серной кислоты (H2SO4). 17. 0,01М раствор серной кислоты (H2SO4). 18. Двухгорлая колба – 1 шт. 19. Делительная воронка – 1 шт. 20. Магнитная мешалка – 1 шт. 21. Секундомер – 4 шт. 22. Коническая колба на 250 мл – 1шт. 23. Бюретка на 25 мл – 1 шт. 24. Мерный цилиндр на 25 мл – 1 шт. 25. Мерные пробирки на 10 мл – 10 шт. 26. Мерные пробирки на 5 мл – 2 шт. 27. Стакан химический на 50 мл – 5 шт.
7 Основные требования техники безопасности при работе в химической лаборатории
1. К работе в химической лаборатории допускаются лица, прошедшие инструктаж по технике безопасности. 2. При работе в химической лаборатории должна использоваться спецодежда и средства индивидуальной защиты: халат хлопчатобумажный, перчатки резиновые, фартук прорезиненный, очки защитные. 3. В химической лаборатории запрещается пробовать на вкус любые реактивы и растворы, принимать пищу и пить из химической посуды. 4. При определении вещества по запаху следует держать склянку на расстоянии и направлять движением руки воздух от отверстия склянки к носу. 5. Опыты с ядовитыми веществами надо проводить в вытяжном шкафу. 6. При смешивании жидкостей с разными плотностями жидкость большей плотности следует вливать в жидкость меньшей плотности. При переливании реактивов нельзя наклоняться над отверстием сосуда во избежание попадания брызг на лицо и одежду. Нельзя наклоняться над нагреваемой жидкостью, так как ее может выбросить. 7. Твердые сыпучие реактивы разрешается брать изсклянок толькос помощью совочков, ложечек, шпателей, пробирок. 8. Без разрешения преподавателя нельзя трогать химические реактивы ипосуду, лабораторные приборы, включать рубильники, электроприборы. 9. Нельзя загромождать свое рабочее место лишними предметами. 10. При проведении эксперимента необходимо соблюдать следующие правила: – работать тщательно, аккуратно, без излишней торопливости; соблюдать тишину в лаборатории; – опыты проводить в чистой посуде; – не расходовать реактивов больше требуемого количества (если же случайно взяли раствора или сухих препаратов больше, чем необходимо, то избыток нельзя возвращать в реактивную склянку); – нельзя уноситьреактивы общего пользования на свое рабочее место; – внимательно наблюдать за ходом опыта, отмечаяи записывая каждую его особенность (выпадение и растворение осадков, изменение окраски, температуры и т.д.); – после опытов остатки металлов в раковину не выбрасывать, а собирать в банку; – не допускается сливать в канализацию растворы, легковоспламеняющиеся и горючие жидкости. Их необходимо собирать для последующего обезвреживания в стеклянную тару с крышкой. 11. При ожогах, вызванных концентрированными кислотами (серной, соляной, азотной), пораженное место должно быть немедленно тщательно промыто быстротекущей струей воды в течение 10–15 минут. После этого пораженное место промывают 5 %-ным раствором перманганата калия или 10 %-ным раствором питьевой соды (одна чайная ложка соды на стакан воды). В случае ожога щелочами пораженное место следует тщательно промыть быстротекущей струей волы в течение 10–15 минут. После этого пораженное место нежно промыть слабым раствором уксусной кислоты (3–6 % по объему) или раствором борной кислоты (одна чайная ложка на стакан воды).
Литература
1. Ахметов, Н.С. Общая и неорганическая химия: учебник для вузов / Н.С. Ахметов. – 5-е изд., испр. – М.: Высш. шк., 2003. – 743 с. 2. Коровин, Н.В. Общая химия: учеб. для технических направ. и спец. вузов / Н.В. Коровин. – 5-е изд., стер. – М.: Выcшая школа, 2004. – 557 с. 3. Карапетьянц, М.Х. Общая и неорганическая химия: учебник для вузов / М.Х. Карапетьянц, С.И. Дракин. – М.: Химия, 1994. – 592 с. 4. Глинка, Н.Л. Общая химия: учебное пособие для вузов / Н.Л. Глинка; под ред. А.И. Ермакова. – 30-е изд., испр. – М.: Интеграл Пресс, 2003. – 728 с. 5. Некрасов, Б.В. Учебник общей химии: для хим. вузов / Б.В. Некрасов. – 4-е изд., перераб. – М.: Химия, 1991. – 560 с. 6. Никольский, А.Б. Химия: учебник для вузов / А.Б. Никольский, А.В. Суворов. – СПб.: Химиздат, 2001. – 512 с. 7. Гольбрайх, З.Е. Сборник задач и упражнений по химии: учеб. пособие для хим.-технол. спец. вузов / З.Е. Гольбрайх, Е.И. Маслов. – 5-е изд., перераб. и доп. – М.: Высшая школа, 1997. – 384 с. 8. Глинка, Н.Л. Задачи и упражнения по общей химии: учебное пособие для вузов / Н.Л. Глинка; под ред. В.А. Рабиновича, Х.М. Рубиной. – М.: интеграл-Пресс, 2003. – 240 с.
Учебное издание Еремина Валерия Валерьевна
Скорость химических реакций
Методические рекомендации для выполнения лабораторных работ по курсам «Общая и неорганическая химия», «Основы общей и неорганической химии», «Химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 240700 «Биотехнология», 260100 «Продукты питания из растительного сырья», 100800 «Товароведение» всех форм обучения
Редактор Соловьева С.В. Технический редактор Сазонова В.П. Подписано в печать 17.08.11. Формат 60´84 1/16 Усл. п. л. 1,98. Уч.-изд. л. 2,13 Печать – ризография, множительно-копировальный аппарат «RISO EZ300»
Тираж 50 экз. Заказ 2011-106 Издательство Алтайского государственного технического университета 656038, г. Барнаул, пр-т Ленина, 46
Оригинал-макет подготовлен ИИО БТИ АлтГТУ Отпечатано в ИИО БТИ АлтГТУ 659305, г. Бийск, ул. Трофимова, 27
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 330; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.72.200 (0.011 с.) |



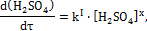


 ,
, , отсюда
, отсюда  .
.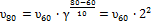 , отсюда
, отсюда  .
.


