
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2.1 Изучение кинетики разложения пероксида водородаСодержание книги
Поиск на нашем сайте
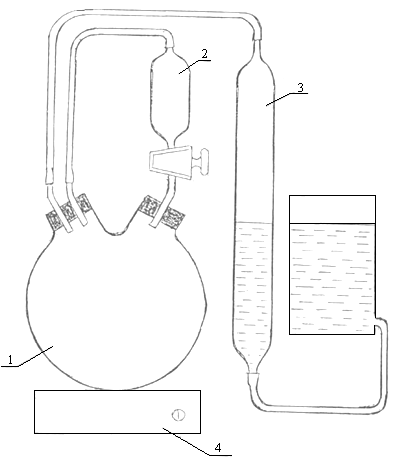
Пероксид водорода при разложении выделяет кислород. Реакция описывается следующим уравнением: 2Н2О2 → 2Н2О + О2 Реакцию проводят в присутствии катализатора. Скорость разложения Н2О2 лучше всего определять по объему выделившегося в заданные промежутки времени кислорода. Реактивы: 10 мл 3 %-ного раствора Н2О2, катализатор МnO2 на подложке (в качестве подложки можно использовать стекло: на стекло наносится тонкий слой клея БФ и напыляется тонкоизмельченный порошок диоксида марганца). Принадлежности к работе: прибор для измерения объема выделившегося кислорода (рисунок 6), двухгорлая колба, делительная воронка, секундомер, магнитная мешалка.
Рисунок 6 – Прибор для измерения выделившегося кислорода при разложении пероксида водорода: 1 – двухгорлая колба, 2 – делительная воронка, 3 – измерительный сосуд, 4 – магнитная мешалка Выполнение работы: бюретку и уравнительный сосуд укрепить так, чтобы уровни воды совпали с нулевым делением на бюретке. Налить в делительную воронку 10 мл пероксида водорода, вставить ее в двухгорлую колбу и соединить с бюреткой. Колбу также присоединить к бюретке (перед присоединением в колбу поместить магнитик и катализатор). Колбу поставить на мешалку. Проверить прибор на герметичность. Открывают кран делительной воронки и сливают пероксид водорода в колбу. Началом реакции считают момент, когда объем раствора в воронке примерно наполовину уменьшится. В этот момент включают секундомер и магнитную мешалку. По мере понижения уровня жидкости в бюретке уравнительную склянку опускают так, чтобы разность уровней была одинаковой. Объем выделившегося кислорода фиксируют каждую минуту. Через 10 минут опыта объем кислорода фиксируют через каждые 2 минуты. Опыт заканчивают, когда объем выделившегося кислорода составит несколько больше половины объема кислорода, который может выделиться при полном разложении Н2О2. Обработка экспериментальных данных: – предварительно, исходя из стехиометрического уравнения, рассчитывают объем кислорода, который может выделиться при полном разложении пероксида водорода (V0∞); – пересчитывают объем кислорода, выделившийся в момент времени на нормальные условия. Расчет ведут по формуле
где Vτ – объем кислорода в момент времени τ, измеренный в условиях опыта, мл; Рат – барометрическое давление в момент проведения опыта, Па; Рнас – давление насыщенного пара воды при температуре Т, К; Т0 – температура при нормальных условиях, К; Т – температура проведения опыта, К; Р0 – давление при нормальных условиях, Па. Находят для каждого момента времени разность объемов (V0∞ – V0τ). Этот объем невыделившегося кислорода пропорционален количеству неразложившегося пероксида водорода. Все экспериментальные и расчетные данные записывают в таблицу 1.
Таблица 1 – Экспериментальные и расчетные данные разложения пероксида водорода
Для нахождения порядка реакции по Н2О2 строят графические зависимости: ln(V0∞ – V0τ)–τ, Если порядок реакции по веществу будет равен 1, 2 или 3, то соответствующая зависимость окажется линейной. По тангенсу угла наклона этой прямой к оси абсцисс рассчитывают константу скорости реакции. Для нахождения порядка реакции по Н2О2 строят графические зависимости: ln(V0∞ – V0τ)–τ, Если ни одна из зависимостей не окажется линейной, то поступают следующим образом (см. п. 1.4, второй способ): – строят зависимость время–объем –[(V0∞ – V0τ)–τ]; – строят график: lnW – ln(V0∞ – V0τ). Тангенс угла наклона полученной прямой – это и есть порядок реакции по Н2О2. После нахождения порядка реакции записывают кинетическое уравнение разложения пероксида водорода и проводят анализ зависимости скорости реакции от концентрации вещества.
Опыт 2.2 Определение константы скорости и порядка Реакции окисления иодид-ионов пероксидом водорода В кислой среде Пероксид водорода окисляет иодид-ионы в кислой среде согласно реакции. 2I– + H2O2 + 2H+→ I2 + 2Н2О (1) При проведении данной реакции, в присутствии ионов тиосульфата натрия образующийся йод быстро восстанавливается тиосульфат-ионами: I2 + 2S2О32– → 2I– + S4О62– (2) Реакцию проводят при наличии избытка кислоты, так что концентрацию ионов водорода можно практически считать постоянной. Реактивы: 100 мл 0,2 %-ного раствора KI, 5 мл 1М раствора H2SО4, 25 мл 0,01М раствора Na2S2O3, 10 мл 1 %-ного раствора Н2О2, 0,05М раствор молибдата аммония, крахмал. Принадлежности к работе: коническая колба на 200 мл, бюретка на 25 мл, мерный цилиндр на 10 мл, секундомер. Выполнение работы: в коническую колбу на 200 мл наливают 100 мл 0,2 %-ного раствора иодида калия и 5 мл 1М раствора H2SО4. В штативе устанавливают бюретку и заполняют ее 0,1М раствором тиосульфата натрия. Из бюретки в колбу отмеривают 1,0 мл раствора Na2S2O3, туда же наливают крахмал (1–2 капли). Отмеривают цилиндром 10 мл 1 %-ного раствора Н2О2 и быстро вливают этот раствор в колбу. В этот момент включают секундомер. Наблюдают за состоянием раствора и записывают момент появления голубой окраски. Эту операцию повторяют пять раз. Затем в колбу добавляют несколько капель раствора молибдата аммония и выделившийся йод титруют до исчезновения голубой окраски. Записывают общий объем тиосульфата натрия, затраченный на проведение опыта. Обработка экспериментальных данных: в присутствии ионов S2О32– реакция (1) будет протекать практически при постоянной концентрации ионов I–. Следовательно, скорость реакции (1) зависит только от концентрации пероксида водорода. Кинетическое уравнение для нее можно записать в виде:
Количество прореагировавшего тиосульфата натрия эквивалентно количеству вступившего в реакцию пероксида водорода. Вместе с тем количество прореагировавшего Na2S2O3 пропорционально его объему. Следовательно, объем тиосульфата натрия (V0), затраченный на проведение опыта, пропорционален начальной концентрации пероксида водорода. К моменту времени τ1 прореагировало количество пероксида водорода, эквивалентное содержанию тиосульфата натрия в 1 мл pacтвора (V1), а оставшееся количество Н2О2 пропорционально (V0 – V1). B последующие моменты появления окраски раствора количество вступившего в реакцию Н2О2 пропорционально (V0 – Vn), где Vn – количество миллилитров Na2S2O3, добавленного к соответствующему моменту времени τn. Экспериментальные и расчетные данные записывают в таблицу 2.
Таблица 2 – Результаты экспериментального определения расхода тиосульфата натрия во времени
Для нахождения порядка реакции по Н2О2 построить графические зависимости: ln(V0 – Vn) – τ, Если порядок реакции по веществу равен 1, 2 или 3, то соответствующая зависимость окажется линейной. По тангенсу угла наклона этой прямой к оси абсцисс рассчитывают константу скорости реакции. Если ни одна из трех зависимостей не является линейной, то константу скорости находят по второму способу (п. 1.4). При этом на графиках вместо концентрации (С) откладывают разность объемов (V0 – Vn).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 914; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.43 (0.008 с.) |




 –τ,
–τ,  .
.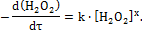

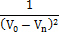
 ,
,  .
.


