Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация кроветворных клетокСодержание книги
Поиск на нашем сайте
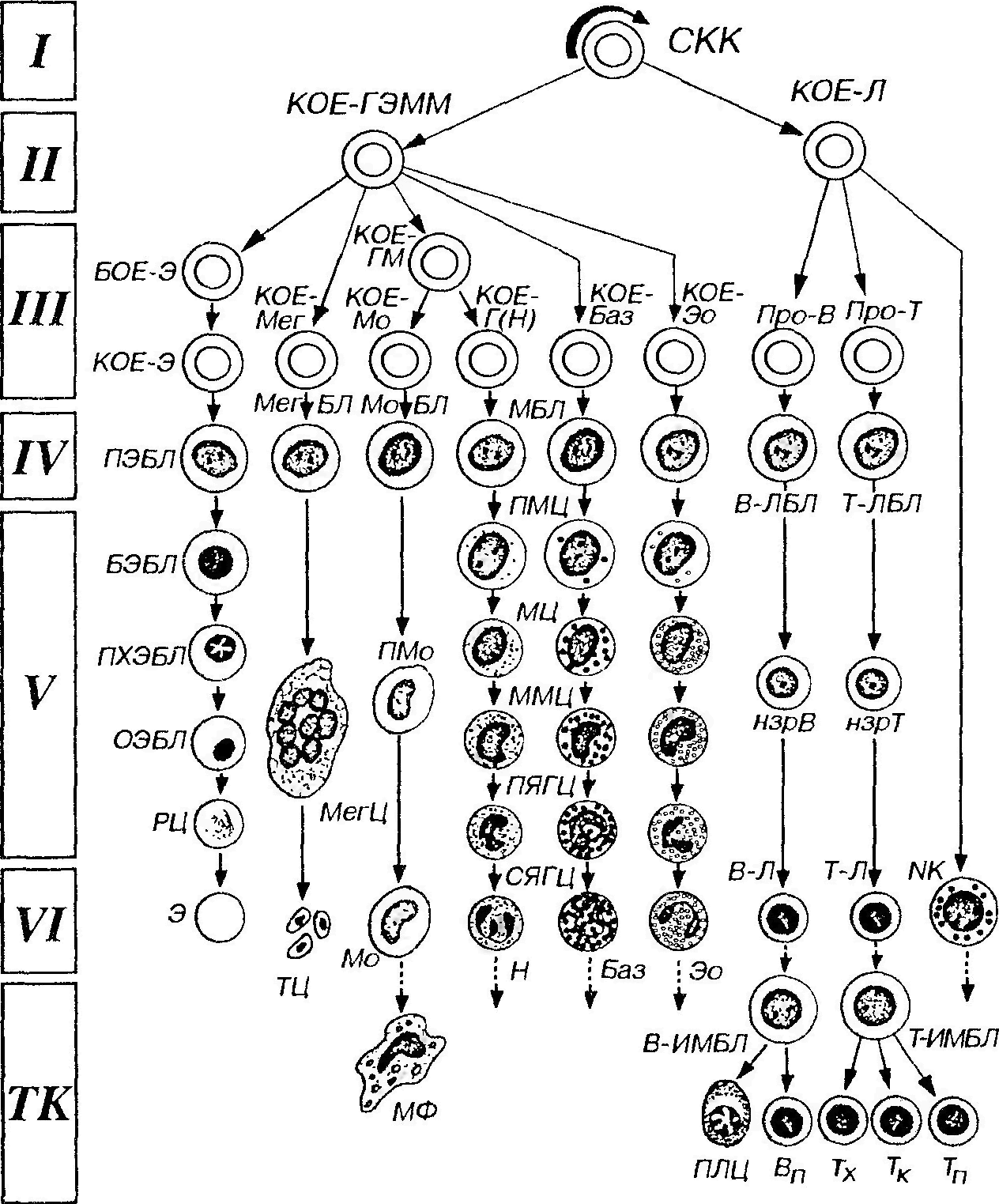
На основании способности с самообновлению, клеточному делению и образованию форменных элементов различных типов кроветворные клетки можно разделить на шесть классов (рис. 29): I класс ̶ плюрипотентные стволовые клетки, которые могут образовывать любые форменные элементы и обладают способностью к самообновлению. II класс ̶ частично детерминированные поли-, или мультипотентные родоначальные клетки, именуемые также полустволовыми клетками. Развиваются из СКК, способны к ограниченному самоподдержанию, являются полипотентными, однако прошедшими первый этап коммитирования клетками, т.е. дающими начало форменным элементам нескольких (но не всех) видов. Родоначальные клетки, относящиеся к данному и следующему (III) классам, называют также колониеобразующими единицами (КОЕ), поскольку в экспериментах на летально облученных мышах они способны давать колонии кроветворных клеток в их органах. Частично детерминированные полипотентные родоначальные клетки включают родоначальную клетку лимфоцитопоэза (КОЕ-Л) и родоначальную клетку миелопоэза (КОЕ-ГЭММ), дающую начало гранулоцитам, эритроцитам, моноцитам и мегакариоцитам. III класс ̶ унипотентные (коммитированные) родоначальные клетки, прошедшие новый этап коммитирования и детерминированные в направлении развития только одного вида форменных элементов (за исключением КОЕ-ГМ, дающей два вида). Они обладают низким потенциалом самоподдержания. Эти клетки не идентифицируются морфологически и внешне сходны с малыми лимфоцитами. Унипотентные (коммитированные) родоначалъные клетки включают: (1) родоначальные клетки эритроцитов ̶ БОЕ-Э ̶ бурст-образующую единицу и развивающуюся из нее КОЕ-Э, (2) КОЕ-Мег ̶ родоначальную клетку мегакариоцитов, (3) КОЕ-ГМ ̶ родоначальную клетку гранулоцитов (нейтрофильных) и моноцитов, дающую КОЕ-Г(Н) ̶ родоначальную клетку гранулоцитов (нейтрофильных) и КОЕ-Мо ̶ родоначальную клетку моноцитов, (4) КОЕ-Баз ̶ родоначальную клетку базофилов, (5) КОЕ-Эо ̶ родоначальную клетку эозинофилов, (6) коммитированные клетки лимфоцитопоэза ̶ про-В-лимфоциты и протимоциты. IV класс ̶ морфологически распознаваемые предшественники ̶ бластные формы. Представляют отдельные линии развития форменных элементов. Пролиферативная активность этих клеток ограничена; способностью к самоподдержанию они не обладают. Название класса отражает тот факт, что, хотя морфологически все клетки этого класса сходны друг с другом, их можно идентифицировать при использовании стандартных гематологических методов окраски, не прибегая к выявлению иммуноцитохимических маркеров. Бластные формы имеют вид крупных клеток с базофильной цитоплазмой и светлым ядром, в котором хорошо определяются ядрышки.
V класс ̶ созревающие (дифференцирующиеся) клетки. Подвергаются структурной и функциональной дифференцировке, образуя соответствующий вид форменных элементов, в ходе которой они (за исключением лимфоцитов и моноцитов) утрачивают способность к делению. VI класс ̶ зрелые (дифференцированные) форменные элементы, циркулирующие в крови. Неспособны к делению (за исключением лимфоцитов и моноцитов).
Рис 29. Схема кроветворения. I-V1 - классы кроветворных клеток, СКК - стволовая клетка крови, КОЕ - колониеобразующая единица (родоначальная клетка): КОЕ-ГЭММ - КОЕ гранулоцитов, эритроцитов, моноцитов и мегакариоцитов. КОЕ-Э - КОЕ эритроцитов, КОЕ-Мег - КОЕ мегакариоцитов, КОЕ-ГМ - КОЕ гранулоцитов (нейтрофильных) и моноцитов, КОЕ-Г(Н) - КОЕ гранулоцитов (нейтрофильных), КОЕ-Мо - КОЕ моноцитов, КОЕ-Баз - КОЕ базофилов, КОЕ-Эо - КОЕ эозинофилов, КО Е-Л - КОЕ лимфоцитопоэза, БОЕ-Э - бурст-образующая единица, про-В - про-В-лимфоцт, про-Т - про-Т-лимфоцит (протимоцит), ПЭБЛ - проэритробласт, БЭБЛ - базофильный эритробласт, ПХЭБЛ - полихроматофильный эритробласт, ОЭБЛ - оксифильный (ортохроматофильный) эритробласт, РЦ - ретикулоцит, Э - эритроцит. МегБЛ - мегакариобласт, МегЦ - мегакариоцит. ТЦ - тромбоциты, МоБЛ - моноцито-бласт, ПМо - промоноцит, Мо - моноцит, МФ - макрофаг, МБ Л - миелобласты, ПМЦ -промиелоциты, МЦ - миелоциты, ММЦ - метамиелоциты, ПЯГЦ – палочкоядерные гранулоциты, СЯГЦ - сегментоядерные гранулоциты (нейтрофильный - Н, базофильный - Баз, эозинофильный - Эо). В-ЛБЛ - В-лимфобласт, нзрВ - незрелый В-лимфоцит, В-Л - В-лимфоцит (зрелый), В-ИМБЛ - В-иммунобласт, ПЛЦ - плазмоцит, Вп - В-клетка памяти, Т-ЛБЛ - Т-лимфобласт, нзрТ - незрелый Т-лимфоцит (Т-Л -T-лимфоцит (зрелый), Т-ИМБЛ - T-иммунобласт, Тх - Т-хелпер, Тк - T-киллер, Тп -T-клетка памяти, NK - NK-клетка. Миграция зрелых клеток из крови в периферические ткани (ТК) обозначена пунктирными стрелками; пути рециркуляции лимфоцитов не отмечены.
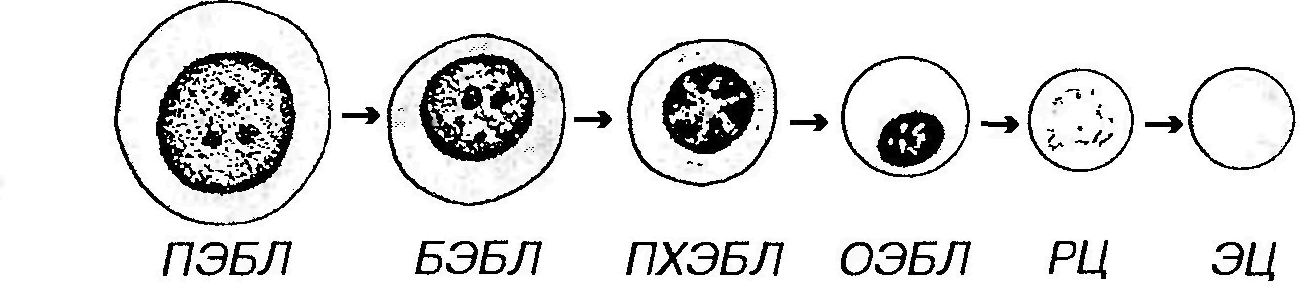
Из зрелых форменных элементов лишь эритроциты и (частично) тромбоциты выполняют свои функции исключительно в кровотоке, лейкоциты же реализуют их после миграции в ткани. Часть клеток при этом подвергается дальнейшим преобразованиям (например, моноциты превращаются в макрофаги и дендритные АПК, лимфоциты под действием антигенной стимуляции подвергаются бласт-трансформации и дальнейшей дифференцировке, основная часть В-лимфоцитов дифференцируется в плазматические клетки). ЭРИТРОПОЭЗ Эритропоэз (эритроцитопозз) ̶ процесс образования и созревания эритроцитов, происходящий в миелоидной ткани. Ход развития эритроцитов из стволовой клетки крови описывается последовательностью: СКК → КОЕ-ГЭММ → БОЕ-Э → КОЕ-Э → проэритробласт → базофильный эритробласт → полихроматофильный эритробласт → оксифильный (ортохроматофильный) эритробласт → ретикулоцит → эритроцит. Эритрон ̶ эритроидный дифферон, представляющий собой совокупность указанных форм ̶ от эритроидных родоначальных клеток до зрелых эритроцитов (включая циркулирующие в крови). БОЕ-Э и КОЕ-Э. БОЕ-Э ̶ бурст-образующая единица (от англ. burst ̶ взрыв) ̶ названа так по своей способности быстро (взрывоподобно) образовывать на полутвердой среде колонию эритроидных клеток численностью в несколько сотен элементов. Она отличается от развивающейся из нее КОЕ-Э более высокой пролиферативной активностью, высокой чувствительностью к ИЛ-3 и низкой ̶ к эритропоэтину. Процесс дифференцировки предшественников эритроцитов в зрелые форменные элементы включает (рис. 30): (1) уменьшение размеров клетки; (2) выработку и накопление гемоглобина в цитоплазме; (3) постепенное снижение содержания и в конечном итоге утрату всех органелл; (4) изменение окраски цитоплазмы от интенсивно базофильной (в связи с большим числом полирибосом) до оксифильной (обусловленной присутствием гемоглобина); (5) снижение, а в дальнейшем (в конце стадии оксифильного эритробласта) - утрату способности к делению; (6) конденсацию ядра и его последующее удаление из клетки.
Рис. 30. Эритропоэз. ПЭБЛ - проэритробласт, БЭБЛ - базофильный эритробласт, ПХЭБЛ - полихроматофильный эритробласт, ОЭБЛ - оксифильный (ортохро-матофильный) эритробласт, РЦ - ретикулоцит, ЭЦ - эритроцит. Проэритробласт ̶ крупная клетка (диаметром около 18-22 мкм) с большим сферическим ядром, содержащим мелкодисперсный хроматин и два-три бледных ядрышка. Цитоплазма умеренно базофильна вследствие присутствия свободных рибосом. Клетка интенсивно пролиферирует, давая начало эритробластам. Последние развиваются в составе так называемых эритробластических островков. Эритробластические островки ̶ особые структурные комплексы в миелоидной ткани, обеспечивающие развитие эритробластов. Их центр образован телом макрофага, который своими многочисленными отростками охватывает окружающие его в один-два слоя эритробласты. По мере созревания эритробласты центробежно смещаются по длине отростков макрофага, удаляясь от его тела и отодвигаясь на периферию эритробластического островка, одновременно приближаясь к поверхности венозного синуса.
Базофильный эритробласт ̶ меньших размеров, чем проэритробласт (12-16 мкм), с более мелким ядром, содержащим умеренно конденсированный хроматин и ядрышки. Цитоплазма резко базофильна благодаря высокому содержанию полисом, активно синтезирующих гемоглобин. Базофильные эритробласты активно делятся. Полихроматофильный эритробласт характеризуется более мелкими размерами, чем базофильный эритробласт (10-12 мкм); его ядро более компактно, чем в базофильном эритробласте, глыбки хроматина в нем распределены в виде спиц колеса, ядрышко не выявляется. Цитоплазма окрашивается полихромно: она воспринимает как основные красители (вследствие наличия в ней многочисленных полисом), так и кислые (из-за накопления в ней оксифильно окрашивающегося гемоглобина). Окраска цитоплазмы может быть либо диффузной и однородной, либо сочетать оксифильные и базофильные участки. Скопления гемоглобина вокруг ядра часто имеют вид оксифильного перинуклеарного ободка. По мере накопления гемоглобина полисомы и другие органеллы редуцируются. Способность клетки к делению сохраняется. Железо, необходимое идя синтеза гема, поступает в цитоплазму эритробластов из двух источников: (1) непосредственно из крови (где оно связано с белком трансферрином) ̶ путем транспорта, опосредованного рецепторами трансферрина на поверхности эритробластов; (2) из цитоплазмы макрофагов, контактирующих с эритробластами в эритробластических островках. Железо в составе ферритина (в комплексе с белком) выделяется на поверхность эритробластов в виде частиц диаметром 6 нм, которые связываются с их гликокаликсом и далее переносятся в их цитоплазму механизмом микропиноцитоза. Небольшие скопления ферритина диаметром 0,1-0,3 мкм (сидеросомы) можно выявить в цитоплазме. Согласно расчетам, второй механизм переносит в 1000 раз больше железа, чем первый. Оксифильный (ортохроматофилъный) эритробласт (нормобласт) образуется путем дифференцировки из полихроматофильного эритробласта. По размерам он чуть крупнее эритроцита. Обладает оксифильно окрашенной цитоплазмой, богатой гемоглобином, в которой органеллы почти полностью отсутствуют. Ядро мелкое, компактное, пикнотическое, расположено эксцентрически. Способность к делению теряется. Выталкивание ядра ̶ наиболее важный этап в процессе превращения оксифильного эритробласта в ретикулоцит. Оно длится несколько минут и может происходить, когда клетка находится в составе эритробластического островка или мигрирует через стенку кровеносных сосудов (синусов) костного мозга в кровоток. Этому процессу предшествует перестройка цитоскелета клетки, образующего структуру в виде манжетки, которая способствует активному выталкиванию ядра с тонким ободком окружающей его цитоплазмы за пределы клетки, где оно быстро фагоцитируется макрофагами.
Ретикулоцит представляет собой безъядерную (постклеточную) структуру. Его оксифильная цитоплазма, почти целиком заполненная гемоглобином, содержит остатки полирибосом и других органелл, которые выявляются при суправитальной окраске в виде базофилъной сеточки. В кровотоке ретикулоцит в течение 24-48 ч превращается в зрелый эритроцит. Длительность всех этапов зритропоэза ̶ от КОЕ-Э до образования зрелого эритроцита равна около 3-7 сут. Регуляция процесса зритропоэза осуществляется рядом гуморальных факторов, из которых наибольшее значение имеют ИЛ-3 (стимулирует пролиферативную активность БОЕ-Э) и эритропоэтин (усиливает пролиферацию КОЕ-Э). Для нормального зритропоэза необходимы также железо, фолиевая кислота и витамин B12. Эритропоэтин продуцируется у взрослого на 90 % почкой, на 10 % печенью (последняя, однако, служит главным его источником у плода) и вырабатывается в ответ на гипоксию. Его действие усиливается андрогенами, гормоном роста, тироксином и ослабляется эстрогенами (поэтому у женщин содержание эритроцитов и гемоглобина в крови ниже, чем у мужчин). ТРОМБОЦИТОПОЭЗ Тромбоцитопоэз ̶ процесс образования и созревания тромбоцитов, происходящий в миелоидной ткани. Тромбоциты образуются в результате процесса частичной фрагментации цитоплазмы гигантских клеток костного мозга ̶ мегакариоцитов. Ход развития мегакариоцитов из стволовой клетки крови описывается последовательностью: СКК → КОЕ-ГЭММ → КОЕ-Мег → мегакариобласт мегакариоцит. Структурно-функциональные изменения мегакариоцита в ходе его созревания. Мегакариоцит при созревании из мегакариобласта становится крупнее, достигая 20-50 мкм (по некоторым сведениям ̶ до 100 мкм) в диаметре; его ядро и цитоплазма претерпевают выраженные изменения. Дифференцировка ядра включает активную репликацию ДНК без митоза. Полиплоидные клетки в дальнейшем претерпевают эндомитоз с образованием многочисленных связанных перемычками долей ядра, в котором общее содержание ДНК соответствует 4-128n (наиболее часто - 16 или 32n). Хроматин постепенно конденсируется, ядрышко, как правило, не выявляется. Размеры клетки обычно соответствуют степени ее полиплоидизации. Дифференцировка цитоплазмы мегакариоцитов начинается только по завершении репликации ДНК. Наиболее заметными ее проявлениями служат: (1) разделение цитоплазмы на три зоны: околоядерную, промежуточную и краевую (периферическую). Околоядерная зона содержит элементы грЭПС, хорошо развитый комплекс Гольджи, митохондрии и центриоли. Промежуточная зона ̶ наибольшая по ширине, содержит гранулы и систему мембранных демаркационных каналов. Краевая (периферическая) зона свободна от большинства органелл и гранул, в ней в значительном количестве сосредоточены элементы цитоскелета (преимущественно актиновые микрофиламенты и ассоциированные с ними белки). Она пересекается демаркационными каналами, связанными с поверхностью клетки.
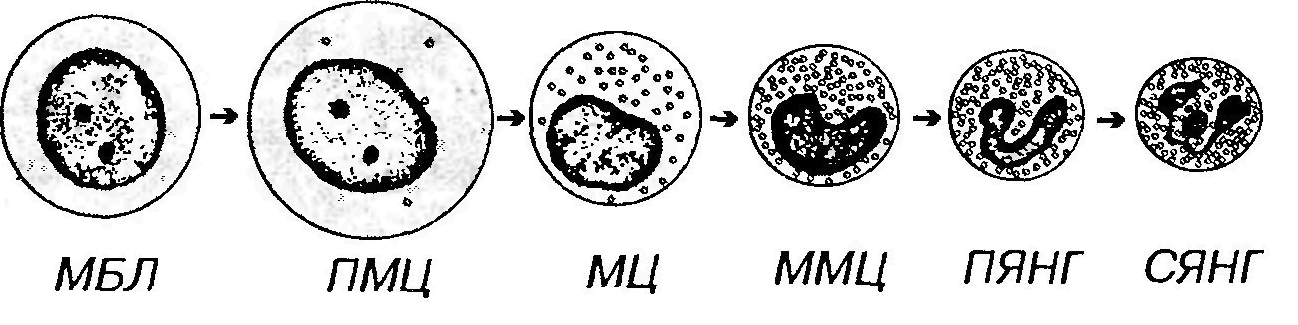
(2) образование и накопление гранул, характерных для тромбоцитов и содержащих типичные для них белки; гранулы отсутствуют в узкой периферической зоне цитоплазмы; (3) формирование системы мембран (демаркационных каналов), разрезающих цитоплазму мегакариоцитов на территории размером 2-4 мкм, соответствующие границам будущих тромбоцитов и содержащие гранулы. Демаркационные каналы возникают предположительно в результате инвагинации плазмолеммы и сообщаются с межклеточным пространством (согласно другим взглядам, они происходят из аЭПС или путем слияния пузырьков, продуцируемых комплексом Гольджи); (4) образование филоподий (протромбоцитов) ̶ узких длинных (2,5×120 мкм) лентовидных отростков мегакариоцитов, которые через поры эндотелия синусов красного костного мозга проникают в их просвет, где распадаются на отдельные тромбоциты. Каждый зрелый мегакариоцит образует несколько тысяч (до 8000) тромбоцитов. В некоторых случаях мегакариоциты способны отделять в просвет сосудов костного мозга крупные фрагменты цитоплазмы. Цикл развития от стволовой клетки до формирования тромбоцитов занимает около 10 суток. Тромбоцитопоэз контролируется рядом гуморальных факторов, из которых наибольшее значение имеют КСФ-Мег (стимулирует пролиферацию КОЕ-Мег) и тромбопоэтин (ускоряет созревание мегакариоцитов). ГРАНУЛОЦИТОПОЭЗ Гранулоцитопоэз – образование и дифференцировка гранулоцитов, происходит в красном костном мозге. Исходным источником развития служит СКК, которая дает начало КОЕ-ГЭММ. Далее из КОЕ-ГЭММ формируются раздельные КОЕ для каждой линии – КОЕ-ГМ (дающей начало КОЕ-Г (нейтрофильных) и КОЕ-Мо), КОЕ-Баз и КОЕ-Эо. Последовательность начальных этапов развития гранулоцитов: (а) нейтрофильных: СКК → КОЕ-ГЭММ → КОЕ-ГМ → КОЕ-Г(Н); (б) базофильных: СКК → КОЕ-ГЭММ → КОЕ-Баз; (в) эозинофильных: СКК → КОЕ-ГЭММ → КОЕ-Эо. Последующие стадии развития гранулоцитов протекают для всех трех типов клеток однотипно (рис. 31): миелобласт → промиелоцит → миелоцит → метамиелоцит →палочкоядерный гранулоцит → сегментоядерный гранулоцит.
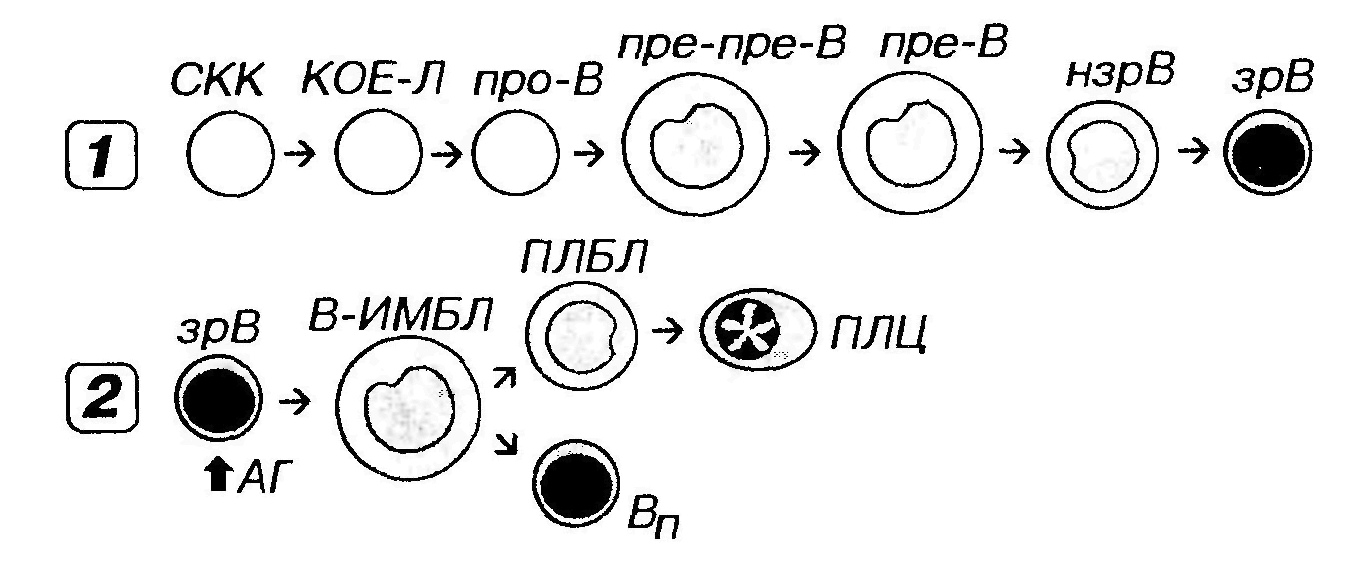
Рис. 31. Гранулоцитопоэз (на примере развития нейтрофильных гранулоцитов). МБЛ - миелобласт, ПМЦ - промиелоцит, МЦ - миелоцит, ММЦ - метамиелоцит, ПЯНГ - палочкоядерный нейтрофильный гранулоцит, СЯНГ - сегментоядерный нейтрофильный гранулоцит. При анализе развития базофильных и эозинофильных гранулоцитов стадии палочкоядерной и сегментоядерной клеток обычно не разделяют. Процесс дифференцировки предшественников гранулоцитов в зрелые клетки включает: (1) уменьшение размеров клетки; (2) снижение, а в дальнейшем (со стадии метамиелопита) ̶ утрату способности к делению; (3) изменение формы ядра ̶ от округлой до бобовидной и палочковидной, его сегментация; нарастание конденсации ядерного хроматина; (4) выработку и накопление гранул в цитоплазме; (5) изменение состава гранул с постепенным увеличением доли специфических гранул и снижением содержания азурофильных; (6) нарастание подвижности клетки, обусловленное перестройкой цитоскелета с увеличением содержания актиновых микрофиламентов; (7) приобретение разнообразных рецепторов плазмолеммы, опосредующих адгезивные взаимодействия с другими клетками и компонентами межклеточного вещества и обеспечивающих важнейшие функции клеток ̶ фагоцитоз, хемотаксис, секреторные реакции. Промиелоцит ̶ крупная клетка, диаметром 16-24 мкм с развитой слабобазофильной цитоплазмой и большим круглым светлым ядром, содержащим мелкодисперсный хроматин и 1-2 ядрышка. Многочисленные полисомы, цистерны грЭПС и крупный комплекс Гольджи обеспечивают образование первичных (азурофильных) гранул (лизосом) диаметром 500 нм, содержание которых по мере созревания промиелоцита увеличивается. К концу этой стадии образование азурофильных гранул завершается. Поэтому, поскольку промиелоцит активно делится, на последующих стадиях содержание этих гранул непрерывно снижается. К концу развития в промиелопите появляются единичные вторичные (специфические - нейтрофильные, базофильные или эозинофильные) гранулы. Миелоцит обычно меньших размеров, чем промиелоцит (диаметр ̶ 10-16 мкм). Характеризуется односторонним уплощением или небольшой инвагинацией эксцентрично расположенного ядра с более крупными гранулами гетерохроматина; ядрышки исчезают. Цитоплазма содержит первичные гранулы (количество которых постепенно падает) и вторичные (специфические) гранулы (число которых непрерывно возрастает благодаря деятельности синтезирующих их грЭПС и комплекса Гольджи). К концу стадии миелоцита вторичных гранул становится больше, чем первичных, происходит накопление гликогена. Миелоцит ̶ последняя митотически активная клетка линии гранулоцитов. Метамиелоцит ̶ меньших размеров, по сравнению с миелоцитом, и отличается от него более заметной инвагинацией ядра, которое принимает бобовидную форму и уплотняется. По ходу созревания метамиелоцита, а позднее на стадиях палочко- и сегментоядерного гранулоцита происходят дальнейшие изменения ядра и цитоплазмы. Ядро изменяет форму ̶ из бобовидного становится подковообразным, а затем палочковидным с последующим формированием перетяжек, разделяющих его на сегменты; конденсация хроматина прогрессивно нарастает. Цитоплазма характеризуется уменьшением количества элементов грЭПС, рибосом, митохондрий, редукцией комплекса Гольджи. В ней появляются третичные гранулы (у нейтрофильных гранулоцитов); внутри специфических гранул образуются кристаллоиды (у эозинофильных гранулоцитов), отмечаются количественные и качественные изменения цитоскелета (обеспечивающие высокую подвижность, образование псевдоподии) и рецепторного аппарата плазмолеммы (обусловливающие высокую способность к хемотаксису, фагоцитозу, адгезивным взаимодействиям и распознаванию различных сигнальных молекул). Цикл развития гранулоцитов в миелоидной ткани включает: (1) стадии, связанные с митотическим делением клеток, ̶ от СКК до миелоцита включительно (длительность ̶ 5-7 сут.); (2) стадии созревания (дифференцировки) постмитотических клеток ̶ начиная с метамиелоцита до сегментоядерных форм (длительность ̶ около 3-4 сут.); (3) накопление структурно зрелых гранулоцитов в костном мозге (длительность ̶ около 4-5 сут.) ̶ создает значительные запасы этих клеток, которые могут выбрасываться костным мозгом при возникновении острой потребности; за счет этой стадии общее количество гранулоцитов в миелоидной ткани в 10 раз превышает их содержание в крови; (4) выделение зрелых клеток в кровь. После циркуляции в крови в течение нескольких часов гранулоциты мигрируют в периферические ткани, где осуществляют свои функции. Регуляция развития гранулоцитов цитокинами осуществляется на различных уровнях и с участием большого количества разнообразных факторов. Наибольшее специфическое стимулирующее влияние оказывают на развитие: нейтрофильных гранулоцитов ̶ Г-КСФ и ГМ-КСФ; эозинофильных гранулоцитов ̶ ИЛ-5 и ГМ-КСФ; базофильных гранулоцитов ̶ ИЛ-3 и ИЛ-4. МОНОЦИТОПОЭЗ Моноцитопоэз ̶ процесс развития моноцитов ̶ происходит в красном костном мозге и описывается последовательностью: СКК → КОЕ-ГЭММ → КОЕ-ГМ → КОЕ-М → монобласт → промоноцит →моноцит. Промоноцит ̶ сравнительно крупная клетка, диаметром 12-18 мкм, с большим светлым слегка вогнутым ядром, в котором располагаются 1-2 ядрышка. Базофильная цитоплазма содержит умеренно развитую грЭПС, полисомы, митохондрии, центриоли и крупный комплекс Гольджи, от которого отделяются незрелые азурофильные гранулы. Промоноциты делятся и постепенно дифференцируются в моноциты. Процесс преобразования монобластов в моноциты включает: (1) дальнейшее увеличение размеров клетки преимущественно за счет нарастания объема цитоплазмы, (2) снижение базофилии цитоплазмы, (3) накопление в ней азурофильных гранул (лизосом), (4) изменение формы ядра, которое становится бобовидным. Моноциты покидают костный мозг вскоре после формирования, не образуя резервного костномозгового пула. Выделяясь в синусы красного костного мозга, они попадают в кровь, в которой циркулируют от 8 ч до 3-4 сут, а далее через стенку сосудов мигрируют в ткани. Лишь около 5%моноцитов, имеющихся в организме, циркулирует в крови, остальные находятся во внесосудистом пуле.В тканях они превращаются в различные виды макрофагов (вместе с которыми образуют единую моноцитарно-макрофагальную систему), а также в дендритные антиген-представляющие клетки. Развитие моноцитов стимулируется М-КСФ и ГМ-КСФ. ЛИМФОЦИТОПОЭЗ Лимфоцитопоэз ̶ развитие лимфоцитов ̶ происходит в красном костном мозге и различных лимфоидных органах и характеризуется их поэтапной миграцией. Красный костный мозг содержит плюрипотентные СКК, которые дают начало частично детерминированным полипотентным родоначальным клеткам лимфоцитопоэза (КОЕ-Л). КОЕ-Л служит источником развития трех видов лимфоцитов ̶ В-лимфоцитов, Т-лимфоцитов и NK-клеток, давая, соответственно, три вида унипотентных (коммитированных) родоначальник клеток ̶ про-В-лимфоциты, протимоциты и (возможно) предшественник NK-клеток. Каждая из этих клеток детерминирована в направлении развития только одного вида лимфоцитов. Последующее развитие Т- и В-лимфоцитов из родоначальных клеток связано с их пролиферацией и дифференцировкой и разделяется на две фазы: антиген-независимую и антиген-зависимую. 1. Антиген-независимая фаза развития Т- и В-лимфоцитов осуществляется в отсутствие антигенов в центральных органах кроветворения и иммуногенеза - тимусе и красном костном мозге (у птиц - фабрициевой сумке), соответственно. Ее наиболее важными этапами служат: (1) миграция коммитированных предшественников из красного костного мозга в центральные органы кроветворения и иммуногенеза. У человека этот этап относится только к развитию Т-лимфоцитов, поскольку у него, как и всех млекопитающих, красный костный мозг одновременно выполняет роль центрального органа по отношению к В-лимфоцитам. Процесс миграции контролируется адгезивными взаимодействиями между эндотелием сосудов тимуса и клетками-предшественниками, а также, возможно, секрецией клетками тимуса хемотаксических факторов. (2) приобретение клетками набора рецепторов на плазмолемме: (а) разнообразных специфических антиген-распознающих рецепторов (образуются в результате реаранжировки части генома, ответственной за антигенную специфичность); (б) ряда добавочных рецепторов, необходимых для взаимодействия с другими клетками; (3) процесс отбора (селекции) клеток с необходимым набором рецепторов и гибель механизмом апоптоза лимфоцитов, не прошедших селекцию; (4) выселение лимфоцитов (прошедших селекцию) в просвет сосудов и их миграция через кровоток из центральных органов кроветворения и иммуногенеза в периферические с заселением их T - и В-зависимых зон (содержащих преимущественно лимфоциты соответствующего вида). Поскольку мигрирующие клетки еще не встречались с антигенами, их называют наивными, или девственными. Направленной миграции способствуют специфические адгезивные взаимодействия между хоминг-рецепторами наивных Т- и В-лимфоцитов и лигандами (адрессинами) на поверхности эндотелия сосудов периферических лимфоидных органов. 2. Антиген-зависимая фаза развития лимфоцитов происходит в периферических органах кроветворения и иммуногенеза (лимфатических узлах, селезенке, миндалинах, пейеровых бляшках, аппендиксе и др.). Она осуществляется в присутствии антигенов (представляемых АПК), сопровождается активацией и пролиферацией лимфоцитов и завершается формированием эффекторных и регуляторных Т-лимфоцитов, плазматических клеток, а также Т- и В-клеток памяти. РАЗВИТИЕ В-ЛИМФОЦИТОВ Последовательность стадий антиген-независимого развития В-лимфоцитов представлена на рис. 32 (1). В ходе развития отмечается реаранжировка генома этих клеток, их выраженные функциональные и иммунофенотипические изменения, а также их некоторые морфологические преобразования.
Рис. 32. Развитие В-лимфоцитов. 1 - антиген-независимое, 2 - антиген-зависимое. СКК - стволовая клетка крови, КОЕ-Л - колониеобразующая единица лимфоцитопоэза, про-В - про-В-лимфоцит, пре-пре-В - пре-пре-В-лимфоцит, пре-В-пре-В-лимфоцит, нзрВ - незрелый В-лимфоцит, зрВ - зрелый В-лимфоцит, АГ - антиген, В-ИМБЛ - В-иммунобласт, ПЛБЛ - плазмобласт, ПЛЦ - плазмоцит, Вп - В-клетка памяти. Про-В-лимфоцит соответствует стадии до реаранжировки генома, которая начинается на уровне npe - npe - B -лимфоцита. В цитоплазме npe -В-лимфоцита выявляется IgM, но он отсутствует на его плазмолемме; для незрелого В-лимфоцита характерна экспрессия IgM на плазмолемме. В зрелом В-лимфоците он экспрессируются совместно clgD. Развитие В-лимфоцитов сопровождается утратой одних клеточных маркеров и приобретением других. Развитие предшественников В-лимфоцитов протекает при контактных взаимодействиях, со стромальными элементами и регулируется рядом цитокинов: ИЛ-1, -2, -3, -4, -5, -6 и -7. Цитологические изменения на ранних стадиях лимфоцитопоэза не столь значительны, как функциональные и иммунофенотипические. Морфологически клетки, находящиеся на стадиях пре-пре- и пре-В-лимфоцита, соответствуют лимфобласту (большому лимфоциту), на стадии незрелого В-лимфоцита ̶ среднему лимфоциту и на стадиизрелого В-лимфоцита ̶ малому лимфоциту. Последовательность стадий антиген-зависимого развития В-лимфоцитов показана на рис. 33. Покидая красный костный мозг, наивные (зрелые) В-лимфоциты, на поверхности которых экспрессируются IgM и IgD, циркулируют в крови и попадают в периферические органы кроветворения и иммуногенеза. В этих органах они взаимодействуют с антигеном, соответствующим по специфичности их рецепторам, а также с Т-хелперами и активируются, подвергаясь бласт-трансформации и превращаясь в течение 1-2 сут. в В-иммунобласты. Последние спустя 3-4 сут. дают начало плазмобластам (далее дифференцирующимся в плазматические клетки) и В-клеткам памяти. Созревание аффинности и соматические гипермутации. В особых структурах периферических органов кроветворения и иммуногенеза (герминативных центрах лимфатических узелков) с антигеном начально взаимодействуют В-лимфоциты, специфические иммуноглобулиновые рецепторы которых обладают по отношению к нему неодинаковой аффинностью (сродством). В дальнейшем, однако, происходит селекция В-лимфоцитов с высокоаффинными рецепторами, которые активно пролиферируют, тогда как клетки с низкоаффинными рецепторами, не получая необходимой для роста стимуляции, подвергаются апоптозу. Соответственно, антитела, которые будут продуцироваться плазматическими клетками ̶ потомками В-лимфоцитов ̶ будут постепенно приобретать все более высокую аффинность (процесс созревания аффинности) и повышенную способность к нейтрализации или элиминации антигена. Эффективной селекции способствует процесс соматической гипермутации, который вносит еще большее разнообразие в обширный репертуар рецепторов, обусловленный ре аранжировкой генома В-лимфоцитов в красном костном мозге. Этот процесс запускается в результате взаимодействия активированных В-лимфоцитов с Т-лимфоцитами. Плазмобласты и плазмоциты. Плазмобласты отличаются от иммунобластов усиленным развитием грЭПС и комплекса Гольджи, синтезом и секрецией иммуноглобулинов. По мере их преобразования в плазматические клетки синтетические процессы еще более усиливаются. Происходит дальнейшее увеличение доли объема цитоплазмы, занятой грЭПС. На светооптическом уровне выявляется усиление базофилии по всей цитоплазме, за исключением светлого околоядерного "дворика", соответствующего месту расположения комплекса Гольджи и центриолей. Ядро уменьшается в размерах, занимает эксцентричное положение в клетке, хроматин конденсируется с образованием характерной картины "спиц колеса". В процессе развития плазматических клеток происходит потеря части специфических маркеров, свойственных В-лимфоцитам (например, связанных с мембраной иммуноглобулинов, рецепторов СЗ-компонента комплемента, Fc-фрагмента иммуноглобулинов, CD19 и CD21). Топография дифференцирующихся плазматических клеток. Образование плазматических клеток может происходить в периферических лимфоидных органах или (при миграции активированных клеток с током крови в периферические ткани) ̶ в собственной пластинке слизистых оболочек, строме желез. Оно осуществляется также в красном костном мозге. Часть В-иммунобластов превращается в долгожиеущие В-клетки памяти с высокоаффинными поверхностными рецепторами, функция которых заключается в обеспечении быстрой реакции на повторный контакт с антигенами. РАЗВИТИЕ Т-ЛИМФОЦИТОВ Последовательность стадий антиген-независимого развития Т-лимфоцитов представлена на рис. 34 (1).
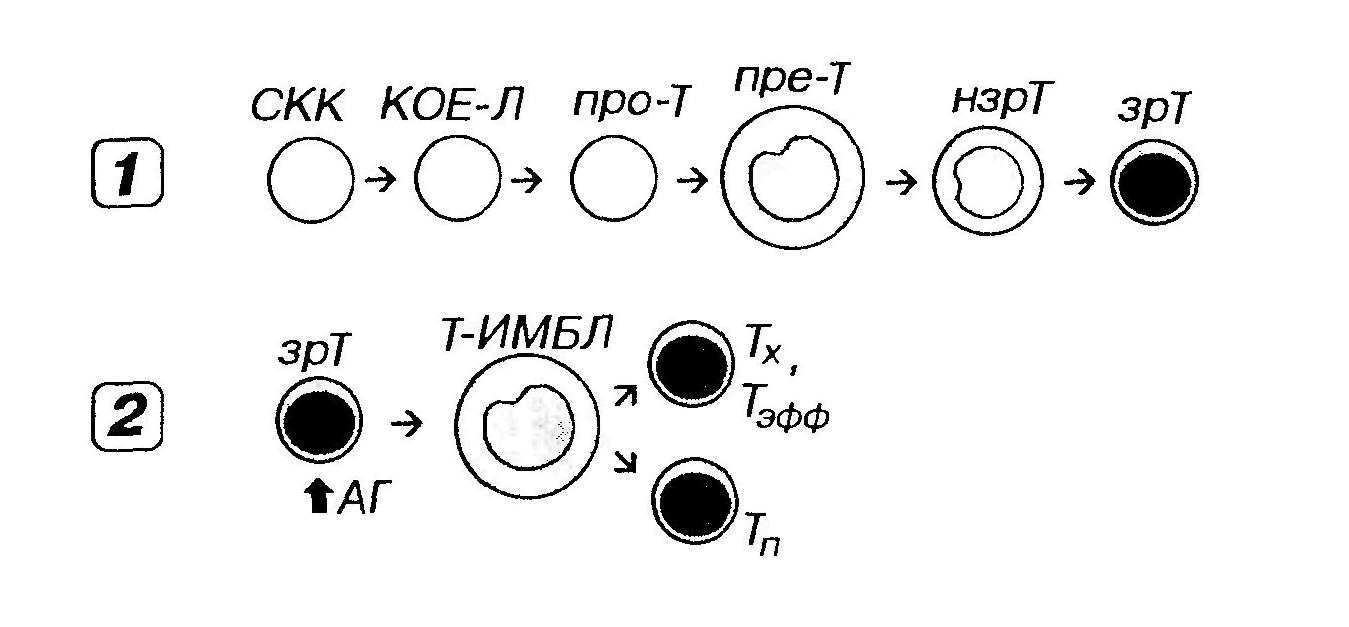
Рис. 34. Развитие T -лимфоцитов. 1 - антиген-независимое, 2 - антиген-зависимое. Про-Т- про-Т-лимфоцит (протимоцит), пре-Т - пре-Т-лимфоцит (претимоцит), нзрТ - незрелый Т-лимфоцит, зрТ - зрелый Т-лимфоцит, зрТ - зрелый Т-лимфоцит, Т-ИМБЛ-Т-иммунобласт, Тэфф - Т-лимфоцит-эффектор, Тх - T -хелпер, Тп -Т-клетка памяти, остальные обозначения - как на рис. 33. Протимоцит (про-Т-лимфоцит) образуется в красном костном мозге из КОЕ-Л и соответствует стадии, предшествующей реаранжировке генома. Претимоцит ̶ наиболее ранняя стадия развития Т-лимфоцитов в тимусе после миграции из красного костного мозга. В нем начинается реаранжировка генома, однако экспрессия Т-клеточных рецепторов (ТКР) на поверхности клетки отсутствует. На плазмолемме имеются поверхностные маркеры, свойственные незрелым клеткам. Незрелые Т-лимфоциты и зрелые Т-лимфоциты ̶ последовательные стадии, идущие за претимоцитами. Эти клетки претерпевают реаранжировку генома с формированием разнообразных специфических антиген-распознающих ТКР, которые экспрессируются на их поверхности. На плазмолемме появляется ряд маркеров, типичных для зрелых Т-лимфоцитов и необходимых для их взаимодействия с другими клетками. Одновременно утрачиваются маркеры, свойственные незрелым клеткам. При этом их фенотип изменяется следующим образом: TKP-/CD3-/CD4-/CD8- → TKP+/CD3+/CD4+/CD8+ → TKP+/CD3+/CD4+/CD8- или TKP+/CD3+/CD4-/CD8+. Морфологически претимоциты соответствуют лимфобластам, незрелые Т-лимфоциты - средним лимфоцитам, а зрелые Т-лимфоциты - малым лимфоцитам. Развитие Т-лимфоцитов в тимусе регулируется их контактными взаимодействиями с эпителиальными клетками, образующими строму этого органа, а также разнообразными гемопоэтипами, продуцируемыми этими клетками. К ним относятся различные КСФ, ИЛ-1, ИЛ-6, а также специфических тимусных факторов – тимозин, тимопоэтин, тимусный сывороточный фактор. Последовательность стадий антиген-зависимого развития Т-лимфоцитов представлена на рис. 34 (2). Покидая тимус, наивные (зрелые) Т-лимфоциты с током крови мигрируют в Т-зависимые зоны периферических органов кроветворения и иммуногенеза. В этих органах они встречаются с антигенами, которые им представляют АПК после процессинга, и взаимодействуют с Т-хелперами. Взаимодействуя с антигенами Т-лимфоциты активируются, подвергаются бласт-трансформации – превращаются в Т-иммунобласты. Последние пролиферируют и дифференцируются, формируя крупные клоны эффекторных и регуляторных клеток.
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 297; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.49.143 (0.012 с.) |