
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электропроводность растворов электролитов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электролитами называются вещества, диссоциирующие под действием растворителя на ионы. В результате этого растворы электролитов проводят электрический ток, перенос электричества в них в отличие от металлов осуществляется положительными и отрицательными ионами. Сильные электролиты в растворе практически полностью диссоциируют на ионы, слабые - частично. Деление электролитов на сильные и слабые является условным, так как зависит не только от природы самого вещества, но и от природы растворителя. Процесс диссоциации слабого электролита, например, СН3СООН,
СН3СООН = H + + СН3СОО- характеризуют степенью диссоциации α, которая для слабых электролитов α ‹‹ 1 и уменьшается с ростом концентрации вещества: α= nd / n0 = Cd / C0 , (nd - число продиссоциировавших молекул, n0 - исходное число молекул в растворе) и константой диссоциации Кд, зависящей только от природы электролита и температуры(закон разведения Оствальда):
(3.1)
где С0 – концентрация кислоты до диссоциации. Для очень слабого электролита α ‹‹ 1, и тогда величиной α в знаменателе можно пренебречь: Кд ≈С0 α2 или При изучении свойств растворов электролитов часто используется кондуктометрический метод, основанный на измерении сопротивления или электрической проводимости изучаемых образцов. Биологические жидкости и некоторые лекарственные препараты являются растворами электролитов. Природа и концентрация ионов, на которые диссоциируют эти вещества, определяют скорость многих биохимических процессов в организме. Кондуктометрический метод дает возможность определить концентрацию и состояние электролитов в желудочном соке, тканевой жидкости и других биологических объектах, а также в водах минеральных источников и продуктах питания. Кондуктометрию применяют при изучении кинетики биохимических процессов, сопровождающихся изменением концентрации электролитов, для изучения проницаемости биологических мембран по отношению к электролитам, а также определения степени и констант диссоциации лекарственных веществ-электролитов для прогнозирования их поведения в организме. Известно, что электрическое сопротивление R любого однородного проводника пропорционально его длине l и обратно пропорционально площади его поперечного сечения S:
где ρ - удельное сопротивление [Ом ∙ м]. Величина W, обратная сопротивлению, называется электропроводностью, ее размерность Ом-1 = См (сименс): W = 1/R= æ где æ называется удельной электропроводностью, т.е. электропроводностью раствора, находящегося между электродами площадью 1 м2, которые расположены на расстоянии 1 м друг от друга. Размерность удельной электропроводности в системе СИ [Ом-1м-1] или [См∙м-1]. Электропроводность раствора электролита, характеризующая его способность проводить электрический ток, зависит от количества носителей тока (ионов) и их скорости. В случае бинарного, например, 1-1-валентного электролита АВ, она определяется выражением: æ =z αCF(u++u- ) (3.5) где z - заряд иона, С- концентрация электролита, α - степень диссоциации, F-число Фарадея, u+ и u-- скорости движения ионов при напряженности поля Е, равной 1 В/см, которые называются электрическими подвижностями ионов.
Рис. 3.1 Зависимость удельной электропроводности от концентрации для сильных (кривая 1) и слабых (кривая 2) электролитов.
В области низких концентраций, увеличение количества вещества в растворе приводит к росту числа ионов и удельной электропроводности. Дальнейшее увеличение концентрации ведет к усилению взаимодействия между ионами и уменьшению электрической подвижности ионов в случае сильных электролитов и снижению степени диссоциации для слабых электролитов. Более удобной величиной для исследования поведения ионов в растворе является молярная электропроводность λ. Она характеризует электропроводность раствора, содержащего 1 моль растворенного вещества, помещенного между двумя электродами, расстояние между которыми равно 1 м: λ = æ∙V (3.6) Величина V=1/C, равная объему раствора, содержащему один моль эквивалента вещества, называется разведением(C- мольная концентрация раствора электролита). В системе СИ размерность λ [ Ом-1м2моль-1] или [См м2моль-1]. Если при этом выразить æ в Ом-1 см-1 , а молярную концентрацию в моль/л, то уравнение (3.6) примет вид: λ =1000 æ/C (3.6’) Изменение молярной электропроводности с увеличением разведения электролита (рис.3.2) обусловлено, главным образом, ростом степени диссоциации слабого электролита и снижением взаимодействия между ионами сильного электролита. Поэтому молярная электропроводность стремится к предельному значению λ ° или λ∞, называемому предельной молярной электропроводностью.
Рис.3.2 Зависимость мольной электропроводности от разведения сильного электролита
Раствор, для которого λ = λ °, называется предельно разбавленным. В таком растворе электролиты, как сильные, так и слабые, полностью диссоциированы на ионы (α=1) и ионы настолько удалены друг от друга, что межионные взаимодействия полностью отсутствуют, и движение разных ионов полностью независимо. В этом случае λ° складывается из двух независимых величин, обусловленных вкладом катионов и анионов (закон Кольрауша): λ °= λ ++ λ- (3.7) где λ + и λ _ - предельные ионные проводимости, связанные с электрической подвижностью ионов u++u- соотношением: λi = Fui (3.8) В кондуктометрических измерениях используют переменный ток, что предотвращает процессы электролиза, которые могут привести к изменению концентрации раствора электролита в процессе измерения электропроводности.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 873; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.119.163 (0.011 с.) |

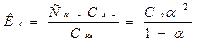
 (3.2)
(3.2) (3.3)
(3.3) , æ =
, æ =  (3.4)
(3.4)





