
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 1. Физико-химический анализ двухкомпонентной смеси.Стр 1 из 13Следующая ⇒
СОДЕРЖАНИЕ ВВЕДЕНИЕ …………………………………………………..…5 ФАЗОВЫЕ ДИАГРАММЫ ……………………………………6 Работа 1 Физико-химический анализ двухкомпонентной смеси…………………………………………………………..……11 Работа 2 Т ермический анализ лекарственных смесей………………………………………………...…………..…16 Работа 3 Изучение взаимной растворимости трехкомпонентной системы…………………………………………………………...20 СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ.……………. 24 Работа 4 Определение изотонического коэффициента i электролита в водном растворе методом криоскопии……………...........................................................................26 ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ …………………………………………………………...…30 Работа 5 Определение электропроводности и константы диссоциации слабого электролита………………………………………………………………..35 Работа 6 Кондуктометрическое титрование……………….…38 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ …………………...…………………………..….42 Работа 7 Измерение ЭДС гальванического элемента…………………………………………………….………….51 Работа 8 Измерение окислительно-восстановительных потенциалов………………………………………………………..……..56 АДСОРБЦИЯ …………………………………………….…...59 Работа 9 Влияние различных факторов на величину адсорбции из растворов…………………………………………………….66 Работа 10 Изучение адсорбции поверхностно-активного вещества (ПАВ) на границе воздух-раствор……………………...68 Работа 11 Исследование поверхностной активности ПАВ одного гомологического ряда…………………………….......……75 ГАЗОВАЯ ХРОМОТОГФИЯ …………………….…………....77 Работа 12 Качественный и количественный анализ углеводородов с помощью газовой хроматографии…...…………………………………………………………84 ХИМИЧЕСКАЯ КИНЕТИКА ……………………………..…91 Работа 13 Изучение кинетики гомогенного каталитического разложения Н2О2…………………………………………………...95 Работа 15 Определение константы скорости инверсии сахарозы…………………………………………………...…………108 ПРИЛОЖЕНИЕ..............................................................................115 ВВЕДЕНИЕ Практикум по физической и коллоидной химии (ч.1) предназначен для студентов медицинского факультета специальности "Фармация" и включает 15 работ. Лабораторные работы выполняются параллельно с изучением теоретического курса. Каждая работа представляет собой небольшое исследование, при проведении которого студенты получают навыки экспериментальной работы, овладевают методами физико-химических измерений, получивших широкое применение в фармации, учатся анализировать полученные экспериментальные данные и на основе этого делать обобщающие выводы.
Для выполнения каждой лабораторной работы необходимо: 1. Изучить по конспекту лекций и учебнику теоретический материал, необходимый для выполнения работы; 2. Внимательно прочитать описание лабораторной работы и ответить на вопросы в конце описания; 3. Выполнить опыт и в лабораторном журнале оформить отчет. В отчете указывается название лабораторной работы, ее цель, записываются основные уравнения и вычисления. Результаты опытов оформляются в виде таблиц и графиков на миллиметровой бумаге. Запрещается вести запись лабораторных работ на отдельных листочках и в черновых тетрадях. В заключении каждого отчета формулируются основные выводы. 4. Защитить лабораторную работу у преподавателя. ФАЗОВЫЕ ДИАГРАММЫ Фазовые диаграммы показывают зависимость состава многокомпонентных систем от внешних факторов (температуры, давления) и описывают происходящие в системах фазовые превращения. Эти диаграммы позволяют делать выводы о составе смеси веществ, их взаимодействии (образовании новых химических соединений и растворов), а также границах их существования. Знание фазовых диаграмм используется в фармацевтическом анализе для идентификации и определения чистоты лекарственных препаратов, выбора наиболее оптимальных путей их выделения из смесей, определения состава смесей для решения вопроса о совместимости лекарственных препаратов. Фазовые диаграммы "состав системы - температура" (диаграммы плавкости) строят на основании кривых охлаждения - зависимости температуры системы от времени ее охлаждения. Число компонентов К и число фаз в системе Ф связаны правилом фаз Гиббса, которое при постоянном давлении выражается уравнением: С = К - Ф + 1 (1.1), где С - число степеней свободы, показывающее количество параметров (число компонентов и температуру), которые можно менять при сохранении заданного числа фаз.
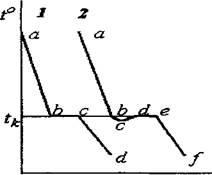
Однокомпонентные системы На рис.1.1 представлены кривые охлаждения для чистого вещества (К=1).
время Рис. 1.1 Кривые охлаждения однокомпонентной системы.
Участок ab кривой 1 соответствует охлаждению жидкого вещества (Ф=1),что соответствует степени свободы С=1, и температура системы непрерывно уменьшается. При температуре кристаллизации tk в точке “ b ” появляются первые кристаллы и система становится двухфазной (Ф=2). При этом на кривой охлаждения наблюдается излом. На участке bс число степеней свободы равно нулю (С=0), и температура в процессе кристаллизации не изменяется (горизонтальный участок площадки на кривой охлаждения). Потери тепла системой компенсируются теплотой выделяющейся при кристаллизации. В точке “ с” исчезают последние капли жидкости и на участке cd происходит охлаждение твердого вещества, при этом С=1. Однако на практике жидкость может переохладиться до температуры ниже tk. Вэтом случае на участке bс кривой 2 образования кристаллов не наблюдается, хотя температура ниже температуры кристаллизации, но после формирования первых кристаллов выделение теплоты кристаллизации приводит к повышению температуры до tк (участок сd кривой 2). В точке “е” кристаллизация заканчивается и на участке ef происходит охлаждение кристаллов С=1.
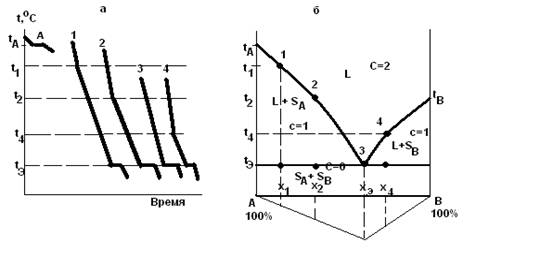
Двухкомпонентные системы Рассмотрим систему из двух веществ А и В (К=2), температуры кристаллизации (плавления) которых tА и tВ. Если не происходит переохлаждения, то для чистого вещества А кривая охлаждения (кривая А рис. 1.2) имеет горизонтальную площадку при температуре tА.
D
F Рис. 1.2 Кривые охлаждения (а) и диаграмма плавкости и треугольник Таммана (б) двухкомпонентной системы.
Для смеси А и В состава x1 температура начала кристаллизации вещества А t1 ниже температуры ta. На кривой охлаждения (рис. 1.2) системы состава x1 началу кристаллизации вещества А соответствует излом при температуре t1. В процессе кристаллизации компонента А его концентрация в жидкости уменьшается, а концентрация В увеличивается, что и приводит к постепенному понижению температуры кристаллизации А вплоть до tэ. По правилу фаз в ходе кристаллизации вещества А из раствора система, содержащая 2 компонентп и 2 фазы, имеет одну степень свободы (С=2-2+1=1), поэтому температура кристаллизации изменяется. Снижение скорости охлаждения системы при температурах ниже t1 связано с выделением в системе теплоты кристаллизации. При температуре tэ жидкий раствор становится насыщенным в отношении вещества В, которое при этих условиях также начинает кристаллизоваться. Система становится трехфазной (жидкость, кристаллы и кристаллы В), и число ее степеней свободы равно нулю (С=2-3+1=0). Таким образом, одновременная кристаллизация А и В из раствора происходит при постоянных температуре (tэ) и составе жидкого раствора (xэ).Эта температура называется эвтектической. На кривой охлаждения 1(рис.1.2) процессу одновременной кристаллизации А и В соответствует площадка при tэ. Расплав, из которого одновременно выпадают кристаллы А и В, называется эвтектическим расплавом, образующаяся при этом смесь мелких кристаллов двух веществ называется эвтектикой. Ниже tэ, система содержит две фазы (кристаллы А и кристаллы B) и число степеней свободы равно 1 (C=2-2+1=1).
Для смеси состава x2 (кривая 2 (рис. 1.2)), содержащей больше веществ В, чем смесь x1, кристаллизация А начинается, в соответствии со сказанным ранее, при более низкой температуре t2. Когда выпадение кристаллов А приведёт к такой концентрации вещества В, что оно также начнёт кристаллизоваться, то температура одновременной кристаллизации A и В будет такой же, как и для смеси 1. Если же взять смесь xэ, состав которой позволяет веществам А и В кристаллизоваться одновременно без предварительного выпадения кристаллов А или кристаллов В, то кривая охлаждения будет изображаться как кривая 3(охлаждение расплава эвтектического состава). Для смеси x4, содержащей избыток вещества В по сравнению с концентрацией xэ, кривая охлаждения подобна кривой 2, но сначала выпадают кристаллы В, и только при достижении состава раствора, допускающего одновременную кристаллизацию А и В, наблюдается горизонтальная площадка при температуре tэ. Чем ближе по составу расплав к эвтектике, тем длиннее горизонтальные участки на кривых охлаждения, так как масса эвтектики увеличивается. Диаграмма состояния двухкомпонентной системы в координатах температура-состав (рис. 1.2,б) строится на основании кривых охлаждения и называется диаграммой плавкости. Например, для чистого вещества А (левая ось ординат диаграммы плавкости) температура кристаллизации tА, для смеси x1, содержащей 20% вещества В, кристаллизация начинается при температуре t1, что на диаграмме соответствует точке 1. Для смесей x2, xЭ и x4 начало кристаллизации показано точками 2, 3 и 4. Следовательно, область диаграммы над линией tА3 и tB3 соответствует жидкому состоянию системы. Такие линии называют линиями ликвидуса от латинского слова liquidus (жидкость), и область диаграммы над ней обозначают буквой L. Твёрдое тело по латыни называется solidus, поэтому существование твердой фазы в области диаграммы обозначают буквой S. Области диаграммы между кривой ta3,tb3 и прямой tЭD отвечают двухфазным (гетерогенным) состояниям системы, так как в ней при этих условиях присутствуют жидкость и кристаллы веществ А или В. Как видно из диаграммы(рис. 1.2.б) есть две области L + S: в левой - жидкая фаза находится в равновесии с кристаллами вещества A (L + SА), а в правой - с кристаллами вещества В (L + SВ). Область диаграммы под прямой tЭD соответствует двум твёрдым фазам и обозначается как (SА + SВ), потому что система в данном случае состоит из смеси кристаллов А и В. Система из трех фаз может существовать только при температуре tЭ ( линия tЭD).
Если на диаграмме отложить по вертикали вниз отрезки, пропорциональные или равные длинам горизонтальных участков(площадок) от оси состава для всех исследованных смесей, и соединить их концы, то можно получить треугольник Таммана (∆ABF). Причем максимальную эвтектическую площадку имеет смесь эвтектического состава. Этот треугольник позволяет экстраполяцией определить эвтектический состав, если он не попал в составы исследуемых смесей. Таким образом, получив из опыта кривые охлаждения ряда смесей с известным соотношением двух данных компонентов, можно построить диаграмму плавкости. Трехкомпонентные системы Для изображения составов трёхкомпонентных систем при постоянных температуре и давлении применяют метод треугольника Гиббса-Розебома. Это равносторонний треугольник (см. рис. 1.3), вершины которого соответствуют индивидуальным чистым веществам А, В и С (однокомпонентные системы). Стороны выражают составы двухкомпонентных систем А и В, В и С, А и С. Все точки внутри треугольника описывают составы трёхкомпонентных систем. Так как в вершине треугольника концентрация вещества максимальна (100%), а на стороне ВС, противоположной этой вершине, она равна нулю, концентрация вещества в системе возрастает при движении от стороны к вершине по любой линии. Для определения состава трехкомпонентной системы пользуются следующими свойствами прямых, проведенных в треугольнике Гиббса-Розебома: 1. Все точки, лежащие на прямой, параллельной стороне треугольника, отвечают растворам с одинаковым содержанием компонента, расположенного в противоположной вершине, и с изменяющимся количеством двух других. 2. На прямой, проходящей через вершину треугольника, например на линии Ае (рис. 1.За),отношение концентраций компонентов В и С одинаково и равно в данном случае отношению отрезков Се: Be = 7:3. Для нахождения состава раствора, отвечающего точке d на диаграмме, достаточно через данную точку провести линии, параллельные сторонам треугольника. Отрезки, отсеченные этими линиями на сторонах треугольника, укажут содержание соответствующих компонентов. Отрезок, gВ (или fC) соответствует 30% вещества А. Отрезок Аb, отсекаемый на стороне АС, линией, параллельной стороне АВ, отвечает 50% вещества С. Концентрация вещества В равна 20%.
а б Рис.1.3 а) Изображение состава трехкомпонентной системы с помощью треугольника Гиббса-Розебома. б) Диаграмма растворимости трех жидкостей, две из которых (В и С) взаимно нерастворимы, а третья (А) неограниченно растворима в первых двух.
На рис. 1.3.б представлен вид диаграммы - изотермы растворимости трёх жидкостей для случая, когда система состоит из двух (С и В) взаимно нерастворимых компонентов и третьего (А), неограниченно растворимого в каждом из первых двух.
Внутри треугольной диаграммы состояния имеются две области - однофазная и двухфазная, а линия, разделяющая эти две области, характеризует составы равновесных насыщенных растворов. Любая фигуративная точка внутри двухфазной области описывает суммарный состав системы, которая распадается на две фазы, различающиеся по составу. Их состав можно определить, проведя ноду kxqo. Например, в точке х в равновесии находятся насыщенные растворы, соответствующие на диаграмме точкам k и q. Все продолжения нод для такой системы сходятся в одной точке вне треугольника, как показано на рис. 1.3.б (правило Тарасенкова) Число степеней свободы для трехкомпонентной системы при постоянных температуре и давлении рассчитывается по формуле: С = 3-Ф
АДСОРБЦИЯ Живые организмы представляют собой системы с очень развитыми поверхностями раздела (кожные покровы, поверхность стенок сосудов, клеточные мембраны и т.д.), на поверхности которых протекают многие жизненно важные биохимические процессы. Поэтому для понимания их механизма необходимо знание основных закономерностей, которым подчиняются поверхностные явления. Состояние молекул, атомов или ионов, расположенных на поверхности жидкости или твердого тела, отличается от состояния частиц, расположенных вдали от поверхности. Происходит это потому, что из-за меньшего числа ближайших соседей у поверхностных частиц (атомов или молекул) по сравнению с частицами, находящимися в объеме, на частицы поверхности действует результирующая сила f, направленная внутрь объемной фазы (рис.5.1).
В результате этого поверхностные частицы обладают избыточной потенциальной энергией, пропорциональной площади межфазной поверхности S.
GS=σS (5.1)
где GS – поверхностная энергия Гиббса системы, σ – поверхностное натяжение σ есть величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оночисленно равно работе, которую необходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре.
В соответствии со вторым началом термодинамики любая система самопроизвольно стремится перейти в такое состояние, при котором её энергия и, в частности, поверхностная энергия, минимальна. Из формулы (5.1) видно, что уменьшение величины GS возможно за счет снижения либо поверхности раздела фаз S, либо поверхностного натяжения σ в результате адсорбции на поверхности других веществ. Адсорбцией называется концентрирование веществ на поверхности раздела фаз. Вещество, поглощаемое поверхностью раздела фаз, называется адсорбатом, а твердое или жидкое вещество, образующее поверхность раздела – адсорбентом. Адсорбция вещества представляет собой обратимый по направлению процесс, заканчивающийся установлением адсорбционного равновесия. При равновесии скорость адсорбции равна скорости обратного процесса - десорбции. Различают физическую адсорбцию и химическую адсорбцию (хемосорбцию), отличающиеся природой сил, действующих между адсорбатом и адсорбентом. В случае физической адсорбции эта сила межмолекулярного взаимодействия, главными из них являются силы Ван-дер-Ваальса, не приводящие к изменению химической природы адсорбированной молекулы и адсорбента. Хемосорбция вызвана силами, возникающими в результате перераспределения электронов между адсорбатом и адсорбентом с образование нового поверхностного соединения, например, оксиды в системе металл-кислород. Адсорбция играет важную роль в природе и технике (в биологических процессах, при разделении и очистке веществ), и, в частности, гетерогенном катализе, поскольку первой стадией любой гетерогенно-каталитической реакции является адсорбция реагентов. В случае адсорбции из растворов количество адсорбированного вещества может быть определено экспериментально как разность между числом молей растворенного вещества в исходном и полученном после установления адсорбционного равновесия растворах:
nS=C0V- СV (5.2)
где nS - число молей адсорбированного вещества, С0 – исходная концентрация растворенного вещества, С – его концентрация после установления адсорбционного равновесия, V – объем взятого раствора. Пусть Vа – объем адсорбционного слоя, S – площадь поверхности адсорбента, Са – концентрация растворенного вещества в адсорбционном слое, можно показать, что
(5.3)
где Г – количество адсорбированного вещества, отнесенное к 1 см2 поверхности (моль/см2). Из формулы (5.3) видно, что его величина определяется разностью между числом молей данного компонента в объеме раствора, прилегающем к поверхности раздела фаз и числом его молей в таком же объеме раствора вдали от поверхности раздела. В зависимости от соотношения количеств вещества в приповерхностном слое и в объеме раствора адсорбция Г может быть положительной и отрицательной, см рис.5.2.
а) б)
Рис 5.2 Изотермы поверхностного натяжения а) и изотермы адсорбции б) для поверхностно-активных (кривая 1), поверхностно-инактивных (кривая 2) и поверхностно-нейтральных (кривая 3) веществ.
Зависимость адсорбции Г от равновесной концентрации при постоянной температуре называется изотермой адсорбции Гиббса. Величина адсорбции и форма изотермы зависят от многих факторов: характера поверхности (интенсивности силового поля), природы адсорбата и адсорбента и температуры. Между адсорбцией, выраженной как избыток адсорбата в адсорбционном слое (адсорбция по Гиббсу) и поверхностным натяжением существует связь, описываемая уравнением Гиббса. В случае адсорбции растворенных веществ
Уравнение (5.4) позволяет рассчитать величину адсорбции, измерив, поверхностное натяжение раствора и его зависимость от концентрации. Поверхностное натяжение зависит от природы жидкости, ее температуры, давления и концентрации растворенных веществ. Измерение величины s биологических жидкостей используют в диагностических целях. Так поверхностное натяжение плазмы крови подвержено сильным колебаниям при различных заболеваниях. Способность растворенных веществ изменять величину s растворителя называется поверхностной активностью:
Для системы газ-жидкость она определяется экспериментально из зависимости σ от С. Вещества, снижающиеповерхностное натяжение растворителя, называются поверхностно-активными веществами (ПАВ); в этом случае dσ/dC<0, а Г > О (кривая 1 на рис.5.2). К таким веществам относятся органические кислоты, спирты, амины и т.д., имеющие полярные гидрофильные группы (-OH,-COOH,-NH2 и др.) и неполярный гидрофобный радикал. Неорганические кислоты, основания, соли являются поверхностно-инактивными веществами dσ/dC > 0 и Г < О (кривая 2). Случай 3 - поверхностно-нейтральное вещество (сахар-вода), которое не изменяет поверхностное натяжение растворителя и Г=0. Рассмотрим причины, вызывающие понижение поверхностного натяжения при растворении в воде поверхностно-активных веществ. Молекулы воды сильно взаимодействуют лишь с полярными группами этих веществ, взаимодействие же между молекулами воды и углеводородными радикалами очень мало. Поэтому молекулы ПАВ преимущественно располагаются в поверхностном слое и ориентируются так, что их полярные группы находятся на поверхности воды, а углеводородные цепи обращены в газовую фазу (рис.5.3а). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой углеводородными цепями; значение, σ при этом уменьшается, приближаясь к значению, характерному для чистого жидкого ПАВ на границе с воздухом. Поверхностная активность ПАВ возрастает по мере увеличения длины углеводородной цепи (рис.5.3б). Согласно правилу Дюкло-Траубе поверхностная активность веществ одного и того же гомологического ряда возрастает в 3 - 3,5 раза при увеличении углеводородной цепи на одну метиленовую группу -СН2 -, т.е. β=gn+1/gn= 3 ÷ 3,5

Рис 5.3 а) Адсорбция ПАВ на границе раствор-воздух, б) лИзотермы поверхностного натяжения и адсорбции ПАВ одного гомологического ряда. Поверхностно-инактивные вещества (электролиты) в воде диссоциируют на ионы, которые благодаря сильному взаимодействию с молекулами воды стремятся уйти с поверхности в объем; лишь незначительная часть их попадает на поверхность вследствие диффузии. В случае адсорбции из растворов на поверхности твердого тела необходимо учитывать, что кроме молекул растворенного вещества на поверхности адсорбента могут адсорбироваться и молекулы растворителя. Увеличение адсорбции одного компонента всегда приводит к уменьшению адсорбции другого. Характер и величина адсорбции зависит от природы растворенного вещества, строения и природы поверхности адсорбента, природы растворителя. Существует эмпирическое правило, согласно которому, чем лучше вещество растворяется в данном растворителе, тем хуже оно из этого растворителя адсорбируется. Другими словами, полярные адсорбенты лучше адсорбируют полярные вещества из неполярных растворителей, а неполярные адсорбенты - неполярные вещества из полярных растворителей. Поэтому неполярные гидрофобные адсорбенты (уголь, сажа) хорошо адсорбируют растворенные вещества из водных растворов, а полярные гидрофильные адсорбенты (каолин, оксид алюминия) лучше адсорбируют растворенные вещества из углеводородных растворителей.
Работа10. Изучение адсорбции поверхностно-активного вещества (ПАВ) на границе воздух-раствор. В данной работе измерение поверхностного натяжения жидкости осуществляется по методу Ребиндера.
Рис.5.4 Трубка 1, вставленная через пробку в пробирку с исследуемой жидкостью, оканчивается капилляром К, который погружается в жидкость не более чем на 1 мм. Пробирка 2 имеет нижнюю трубку с зажимом 7 и боковую трубку, соединяющую ее с манометром 3 и аспиратором 4. Манометр заполнен дистиллированной водой. Выпуская воду из аспиратора 4 через зажим 5 в стакан 6, уменьшают давление над поверхностью исследуемой жидкости Р2 по сравнению с атмосферным Р1 за счет увеличения объема, занятого воздухом в герметичной системе. Разряжение в трубках вызывает продавливание воздуха через трубку 1, который в виде пузырьков выходит из конца капилляра К, опущенного в жидкость. Скорость образования пузырьков регулируется зажимом 5. Если через капилляр с известным радиусом r, погруженный на небольшую глубину в исследуемую жидкость, подавать воздух, то давление в капилляре постепенно увеличивается до тех пор, пока пузырек воздуха, образующейся у конца капилляра, не примет форму полусферы. После этого для отрыва пузырька уже не требуется дальнейшего увеличения давления. Сила, способствующая образованию пузырька, пропорциональна давлению, а сила, препятствующая его образованию, пропорциональна поверхностному натяжению σ. Разность внешнего Р1 и внутреннего Р2 давлений пропорциональна поверхностному натяжению жидкости:
Р=Р1-Р2=2σ/r
где r- радиус капилляра. Для двух жидкостей с различными значениями поверхностного натяжения, например, для растворителя H2O и раствора
σ0=rP0/2 и σ =rP/2, откуда P0/P=σ0/σ
или σ =σ0Р/Р0 (5.6)
где σ0 и σ – поверхностное натяжение двух разных жидкостей (растворителя и раствора), Р0 и Р – соответствующие им избытки давления над внешним давлением при образовании пузырька. Если известно значение поверхностного натяжения одной из жидкостей, то по формуле (5.6) можно определить величину σ для другой. В лабораторной работе определение поверхностного натяжения раствора проводится методом сравнения и его величина рассчитывается по формуле (5.6). В качестве жидкости с известным поверхностным натяжением берется дистиллированная вода. Зависимость поверхностного натяжения воды от температуры приведена в таблице 7 приложения.
Цель работы: По результатам определения поверхностного натяжения раствора ПАВ построить изотерму адсорбции ПАВ на поверхности воды. Порядок выполнения работы: 1. Получить у лаборанта прибор для определения поверхностного натяжения. Проверить уровень воды в манометре, а также достаточно ли плотно закрываются пробками пробирки 2 и аспиратор 4. Уровень воды в манометре должен составлять половину от его высоты, в воде не должно быть пузырьков воздуха, а в соединительной трубке капель воды. Приготовить рабочие растворы. 2. Закрепить прибор в штативе, промыть пробирку 2 и трубку с капилляром 1 дистиллированной водой. 3. Залить дистиллированную воду в аспиратор 4 и плотно закрыть его пробкой. Дистиллированную воду залить также в пробирку 2 так, чтобы при погружении в воду конец капилляра находился на глубине не более 1 мм. При этом пробка должна плотно закрывать пробирку. 4. При медленном выливании воды из аспиратора 4 через зажим 5 на конце капилляра образуются и проскакивают через жидкость пузырьки. В этот момент разность Р между атмосферным давлением и давлением внутри прибора максимальна. Определить максимальный h max и минимальный h min уровень воды в коленах манометра при проскоке пузырька через жидкость. Измерения провести не менее трех раз и записать в таблицу 5.2. Найти средние значения h max и h min и максимальную разность давлений по формуле
Р мм вод. ст.= h max - hmin Таблица 5.2. Зависимость поверхностного натяжения от концентрации растворов ПАВ. Температура опыта………. 0С.
5. Через нижнюю трубку вылить воду из пробирки 2, выдуть воду из капилляра и осушить его с помощью фильтровальной бумаги. Промыть пробирку 2 и капилляр исследуемым раствором, заполнить пробирку 2 исследуемым раствором и измерить давление Р, как указано в п.п.3,4. Концентрации растворов ПАВ, поверхностные натяжения которых надо определить, указаны в табл.5.2. Измерения начинать с наиболее разбавленного раствора. При переходе к новому раствору пробирку с капилляром несколько раз промыть этим раствором. 6. По формуле (5.6) рассчитать поверхностное натяжение растворов ПАВ. 7. По данным табл.5.2 построить изотерму поверхностного натяжения- зависимость σ - С в масштабе, удобном для графического дифференцирования. 8. Из изотерм поверхностного натяжения рассчитать величины поверхностных активностей dσ/ dC. Как видно из рис.5.5, методика графического дифференцирования состоит в следующем: при каждой концентрации ПАВ С выбирают отрезок (справа и слева от С равноотстоящие значения) и находят тангенс угла наклона прямой, считая, что в узком В случае ПАВ поверхностные активности имеют отрицательные значения.
Таблица 5.3 Зависимость адсорбции от концентрации ПАВ в растворе.
9. Рассчитать величину адсорбции ПАВ, по формуле (5.7)
где R = 8,31 107 эрг/моль град, Т - температура в градусах Кельвина, С - концентрация раствора в моль/л. Значения Г записываются в табл.5.3, по данным которой строят изотерму адсорбции - зависимость Г от концентрации ПАВ.
Контрольные вопросы Перед выполнением работы: 1. Что называется поверхностным натяжением? Какие вещества называются поверхностно активными? 2. Какие параметры измеряются при определении поверхностного натяжения методом Ребиндера? 3. Когда нужно производить измерение давления по водяному манометру? 4. Зачем нужно проводить опыт с дистиллированной водой? 5. Почему нельзя погружать капилляр глубоко в раствор при измерении поверхностного натяжения? 6. Почему нужно начинать опыт с воды, а затем брать для опытов растворы в порядке возрастания концентрации растворенного поверхностно активного вещества и удалять жидкость из капилляра перед переходом к работе с раствором другой концентрации? 7. Как должно изменяться давление, необходимое для отрыва пузырька воздуха в этом ряду растворов? 8. Как рассчитать поверхностное натяжение растворов на основании полученных значений давления? 9. Запишите уравнение Гиббса, связывающее поверхностное натяжение и адсорбцию. 10. Каким образом из графика зависимости поверхностного натяжения от концентрации растворенного вещества можно рассчитать величины адсорбции? К защите работы: 1. Как зависит поверхностное натяжение от концентрации в случае поверхностно-активного вещества? 2. Дайте определение понятия адсорбции. Почему адсорбция является самопроизвольным процессом? 3. Что такое поверхностная активность вещества? 4. Какие вещества относятся к поверхностно-активным и поверхностно-инактивным? Почему? 5. Как зависит адсорбция от концентрации в случае поверхностно-инактивного вещества? 6. Изобразите схематически, как ориентируются молекулы ПАВ в адсорбционном слое на границах раздела вода-воздух, бензол-вода. 7. Как будет меняться поверхностная активность веществ (ПАВ) одного гомологического ряда при увеличении углеводородной цепи? 8. Рассчитайте поверхностную активность раствора ПАВ с концентрацией 0,075 М при 298 К, если адсорбция равна 7∙10-10 моль/см2 (R=8,31∙107 эрг/моль)
Работа 11. Исследование поверхностной активности ПАВ одного гомологического ряда.
Цель работы: Определить поверхностную активность ПАВ одного гомологического ряда. Проверить выполнимость правила Дюкло-Траубе. Порядок выполнения работы: 1. Методом Ребиндера (см. п.п.1-5 работы 9) определить поверхностное натяжение растворов спиртов двух концентраций: для изопропилового и изобутилового спиртов 0,05 и 0,025 моль/л; для изоамилового спирта 0,025 и 0,0125 моль/л. Поверхностное натяжение растворов ПАВ σ рассчитать по формуле (5.6). Результаты представить в виде таблицы.
Таблица 5.4 Определение поверхностной активности ПАВ одного гомологического ряда.
Примечание: Измерение h max и h min выполнить по 3 раза и взять средние значения. При переходе к следующему раствору необходимо осушить капилляр фильтровальной бумагой, а при замене ПАВ промыть капилляр новым раствором. 2. Построить графики зависимости σ от С и определить поверхностную активность каждого ПАВ по формуле
3. Рассчитать отношение поверхностных активностей спиртов gn+1/gn. Сделать вывод о выполнимости правила Дюкло-Траубе. Контрольные вопросы Перед выполнением работы: 1. Как можно измерить повер
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 591; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.108.54 (0.163 с.) |





 (5.4)
(5.4) (5.5)
(5.5)
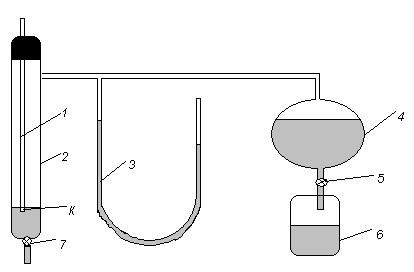 Прибор для определения поверхностного натяжения показан на рис.5.4.
Прибор для определения поверхностного натяжения показан на рис.5.4.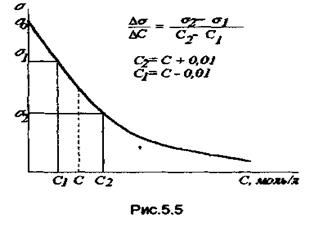
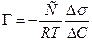 (5.7)
(5.7)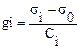 , где σi поверхностное натяжение раствора ПАВ с концентрацией Сi, σ0 - поверхностное натяжение воды.
, где σi поверхностное натяжение раствора ПАВ с концентрацией Сi, σ0 - поверхностное натяжение воды.


