Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 9. Влияние различных факторов на величину адсорбции из растворов.Содержание книги
Поиск на нашем сайте
Цель работы: Установить влияние природы адсорбента, адсорбата и растворителя на адсорбцию веществ из растворов. Порядок выполнения работы: 1. Установить, к каким классам (кислотным или основным красителям) относятся метиленовый синий и эозин с помощью метода капиллярного анализа. Для этого на листок фильтровальной бумаги нанести по 1 капле водных растворов указанных красителей, а также 1 каплю смеси эозина и метиленового синего. Имея в виду, что поверхность волокон фильтровальной бумаги при смачивании ее водой приобретает отрицательный заряд, определить по степени растекания капель во всех пробах, какие по знаку заряды несут окрашенные ионы. 2. Установить влияние природы растворителя на величину адсорбции красителя на активированном угле. Для этого в одну пробирку налить 10 мл водного, а в другую - 10 мл этанольного раствора метиленового синего одинаковой концентрации. В каждую пробирку внести небольшие равные количества активированного угля. Содержимое пробирок взболтать и отфильтровать. Сравнить интенсивность окраски фильтратов. Выводы по п.п.1-2 занести в таблицу 5.1. 3. В 4 пробирки налить по 5 мл 0.02% раствора FeCl3, метиленовый сини, эозина, K2Cr2O7. Добавить 0.1г активированного угля и после перемешивания отфильтровать. Отметить, как изменилась окраска растворов после адсорбции. Промыть уголь на фильтре водой. Вымывается ли краситель водой? Уголь на фильтре промыть 1-2 мл ацетона. Объяснить, почему ацетон окрашивается. 4. В пробирку налить 5 мл 0.02% раствора метиленовой сини и насыпать 0.1 г активированного угля, взбалтывать несколько минут, отфильтровать. Отметить окраску раствора. Добавить на фильтр 2-3 мл хлороформа. Отметить окраску фильтрата. Затем на фильтр налить воду и опять отметить окраску фильтрата. Объяснить наблюдаемые явления, учитывая, что метиленовая синь нерастворима в СНСI3.
Таблица 5.1 Влияние природы адсорбента и адсорбата на адсорбцию из растворов.
Контрольные вопросы К защите работы 1. Что такое адсорбция, адсорбент, адсорбат? 2. Приведите примеры полярных и неполярных адсорбентов. 3. Почему адсорбция является самопроизвольным процессом? 4. Какие факторы влияют на величину адсорбции ПАВ из водного раствора? Объясните характер влияния природы ПАВ и адсорбента. 5. Почему природа растворителя оказывает влияние на адсорбцию? 6. Предложите адсорбент для удаления фенола из воды. Объясните свой выбор. 7. Почему по степени растекания пятна красителя на фильтровальной бумаге можно определить, к какому классу относится краситель?
Работа10. Изучение адсорбции поверхностно-активного вещества (ПАВ) на границе воздух-раствор. В данной работе измерение поверхностного натяжения жидкости осуществляется по методу Ребиндера.
Рис.5.4 Трубка 1, вставленная через пробку в пробирку с исследуемой жидкостью, оканчивается капилляром К, который погружается в жидкость не более чем на 1 мм. Пробирка 2 имеет нижнюю трубку с зажимом 7 и боковую трубку, соединяющую ее с манометром 3 и аспиратором 4. Манометр заполнен дистиллированной водой. Выпуская воду из аспиратора 4 через зажим 5 в стакан 6, уменьшают давление над поверхностью исследуемой жидкости Р2 по сравнению с атмосферным Р1 за счет увеличения объема, занятого воздухом в герметичной системе. Разряжение в трубках вызывает продавливание воздуха через трубку 1, который в виде пузырьков выходит из конца капилляра К, опущенного в жидкость. Скорость образования пузырьков регулируется зажимом 5. Если через капилляр с известным радиусом r, погруженный на небольшую глубину в исследуемую жидкость, подавать воздух, то давление в капилляре постепенно увеличивается до тех пор, пока пузырек воздуха, образующейся у конца капилляра, не примет форму полусферы. После этого для отрыва пузырька уже не требуется дальнейшего увеличения давления. Сила, способствующая образованию пузырька, пропорциональна давлению, а сила, препятствующая его образованию, пропорциональна поверхностному натяжению σ. Разность внешнего Р1 и внутреннего Р2 давлений пропорциональна поверхностному натяжению жидкости:
Р=Р1-Р2=2σ/r
где r- радиус капилляра. Для двух жидкостей с различными значениями поверхностного натяжения, например, для растворителя H2O и раствора
σ0=rP0/2 и σ =rP/2, откуда P0/P=σ0/σ
или σ =σ0Р/Р0 (5.6)
где σ0 и σ – поверхностное натяжение двух разных жидкостей (растворителя и раствора), Р0 и Р – соответствующие им избытки давления над внешним давлением при образовании пузырька. Если известно значение поверхностного натяжения одной из жидкостей, то по формуле (5.6) можно определить величину σ для другой. В лабораторной работе определение поверхностного натяжения раствора проводится методом сравнения и его величина рассчитывается по формуле (5.6). В качестве жидкости с известным поверхностным натяжением берется дистиллированная вода. Зависимость поверхностного натяжения воды от температуры приведена в таблице 7 приложения.
Цель работы: По результатам определения поверхностного натяжения раствора ПАВ построить изотерму адсорбции ПАВ на поверхности воды. Порядок выполнения работы: 1. Получить у лаборанта прибор для определения поверхностного натяжения. Проверить уровень воды в манометре, а также достаточно ли плотно закрываются пробками пробирки 2 и аспиратор 4. Уровень воды в манометре должен составлять половину от его высоты, в воде не должно быть пузырьков воздуха, а в соединительной трубке капель воды. Приготовить рабочие растворы. 2. Закрепить прибор в штативе, промыть пробирку 2 и трубку с капилляром 1 дистиллированной водой. 3. Залить дистиллированную воду в аспиратор 4 и плотно закрыть его пробкой. Дистиллированную воду залить также в пробирку 2 так, чтобы при погружении в воду конец капилляра находился на глубине не более 1 мм. При этом пробка должна плотно закрывать пробирку. 4. При медленном выливании воды из аспиратора 4 через зажим 5 на конце капилляра образуются и проскакивают через жидкость пузырьки. В этот момент разность Р между атмосферным давлением и давлением внутри прибора максимальна. Определить максимальный h max и минимальный h min уровень воды в коленах манометра при проскоке пузырька через жидкость. Измерения провести не менее трех раз и записать в таблицу 5.2. Найти средние значения h max и h min и максимальную разность давлений по формуле
Р мм вод. ст.= h max - hmin Таблица 5.2. Зависимость поверхностного натяжения от концентрации растворов ПАВ. Температура опыта………. 0С.
5. Через нижнюю трубку вылить воду из пробирки 2, выдуть воду из капилляра и осушить его с помощью фильтровальной бумаги. Промыть пробирку 2 и капилляр исследуемым раствором, заполнить пробирку 2 исследуемым раствором и измерить давление Р, как указано в п.п.3,4. Концентрации растворов ПАВ, поверхностные натяжения которых надо определить, указаны в табл.5.2. Измерения начинать с наиболее разбавленного раствора. При переходе к новому раствору пробирку с капилляром несколько раз промыть этим раствором. 6. По формуле (5.6) рассчитать поверхностное натяжение растворов ПАВ. 7. По данным табл.5.2 построить изотерму поверхностного натяжения- зависимость σ - С в масштабе, удобном для графического дифференцирования. 8. Из изотерм поверхностного натяжения рассчитать величины поверхностных активностей dσ/ dC. Как видно из рис.5.5, методика графического дифференцирования состоит в следующем: при каждой концентрации ПАВ С выбирают отрезок (справа и слева от С равноотстоящие значения) и находят тангенс угла наклона прямой, считая, что в узком В случае ПАВ поверхностные активности имеют отрицательные значения.
Таблица 5.3 Зависимость адсорбции от концентрации ПАВ в растворе.
9. Рассчитать величину адсорбции ПАВ, по формуле (5.7)
где R = 8,31 107 эрг/моль град, Т - температура в градусах Кельвина, С - концентрация раствора в моль/л. Значения Г записываются в табл.5.3, по данным которой строят изотерму адсорбции - зависимость Г от концентрации ПАВ.
Контрольные вопросы Перед выполнением работы: 1. Что называется поверхностным натяжением? Какие вещества называются поверхностно активными? 2. Какие параметры измеряются при определении поверхностного натяжения методом Ребиндера? 3. Когда нужно производить измерение давления по водяному манометру? 4. Зачем нужно проводить опыт с дистиллированной водой? 5. Почему нельзя погружать капилляр глубоко в раствор при измерении поверхностного натяжения? 6. Почему нужно начинать опыт с воды, а затем брать для опытов растворы в порядке возрастания концентрации растворенного поверхностно активного вещества и удалять жидкость из капилляра перед переходом к работе с раствором другой концентрации? 7. Как должно изменяться давление, необходимое для отрыва пузырька воздуха в этом ряду растворов? 8. Как рассчитать поверхностное натяжение растворов на основании полученных значений давления? 9. Запишите уравнение Гиббса, связывающее поверхностное натяжение и адсорбцию. 10. Каким образом из графика зависимости поверхностного натяжения от концентрации растворенного вещества можно рассчитать величины адсорбции? К защите работы: 1. Как зависит поверхностное натяжение от концентрации в случае поверхностно-активного вещества? 2. Дайте определение понятия адсорбции. Почему адсорбция является самопроизвольным процессом? 3. Что такое поверхностная активность вещества? 4. Какие вещества относятся к поверхностно-активным и поверхностно-инактивным? Почему? 5. Как зависит адсорбция от концентрации в случае поверхностно-инактивного вещества? 6. Изобразите схематически, как ориентируются молекулы ПАВ в адсорбционном слое на границах раздела вода-воздух, бензол-вода. 7. Как будет меняться поверхностная активность веществ (ПАВ) одного гомологического ряда при увеличении углеводородной цепи? 8. Рассчитайте поверхностную активность раствора ПАВ с концентрацией 0,075 М при 298 К, если адсорбция равна 7∙10-10 моль/см2 (R=8,31∙107 эрг/моль)
Работа 11. Исследование поверхностной активности ПАВ одного гомологического ряда.
Цель работы: Определить поверхностную активность ПАВ одного гомологического ряда. Проверить выполнимость правила Дюкло-Траубе. Порядок выполнения работы: 1. Методом Ребиндера (см. п.п.1-5 работы 9) определить поверхностное натяжение растворов спиртов двух концентраций: для изопропилового и изобутилового спиртов 0,05 и 0,025 моль/л; для изоамилового спирта 0,025 и 0,0125 моль/л. Поверхностное натяжение растворов ПАВ σ рассчитать по формуле (5.6). Результаты представить в виде таблицы.
Таблица 5.4 Определение поверхностной активности ПАВ одного гомологического ряда.
Примечание: Измерение h max и h min выполнить по 3 раза и взять средние значения. При переходе к следующему раствору необходимо осушить капилляр фильтровальной бумагой, а при замене ПАВ промыть капилляр новым раствором. 2. Построить графики зависимости σ от С и определить поверхностную активность каждого ПАВ по формуле
3. Рассчитать отношение поверхностных активностей спиртов gn+1/gn. Сделать вывод о выполнимости правила Дюкло-Траубе. Контрольные вопросы Перед выполнением работы: 1. Как можно измерить поверхностное натяжение водных растворов ПАВ? 2. Как рассчитать поверхностную активность вещества? Какие для этого нужны данные? К защите работы: 1. Как формулируется правило Дюкло-Траубе? 2. Нарисуйте на одном графике изотермы поверхностного натяжения масляной, уксусной и пропионовой кислот. 3. Нарисуйте изотермы адсорбции этих кислот. 4. Во сколько раз поверхностная активность уксусной кислоты отличается от поверхностной активности масляной кислоты при условии равенства концентраций их растворов? 5. В качестве противоядия при отравлениях метанолом применяют этанол. Почему? ГАЗОВАЯ ХРОМАТОГРАФИЯ Хроматография широко используется в медико-биологических исследованиях и клинической практике для диагностики различных заболеваний, анализа сложных лекарственных препаратов и определения их чистоты, изучения их метаболизма в организме. Хроматография – физико-химический метод разделения и анализа сложных смесей, при котором компоненты смеси распределяются между двумя фазами: неподвижной (с большой поверхностью контакта) и подвижной (в виде потока, фильтрующегося через неподвижный слой). Анализируемые вещества растворены в подвижной фазе. Перемещаясь вдоль неподвижной фазы, помещенной в трубку, которая называется хроматографической колонкой, они взаимодействуют с ней, в результате чего изменяется скорость их движения. Чем больше среднее "время жизни" молекул индивидуального вещества в сорбированном состоянии, тем меньше их средняя скорость движения вдоль колонки, так как движение веществ вдоль колонки происходит только с потоком газа-носителя, в то время, как в сорбированном состоянии они направленно не движутся. Вещества, слабо взаимодействующие с неподвижной фазой, вымываются быстрее. Наоборот, сильное взаимодействие снижает скорость перемещения компонентов вдоль стационарной фазы. Результаты хроматографического разделения смеси веществ регистрируются в виде хроматограммы, которая представляет зависимость сигнала детектора, пропорционального концентрации компонента смеси в газе-носителе от времени. Таким образом, хроматограмма показывает
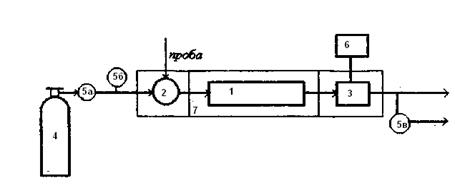
последовательность выхода компонентов и их количества, пропорциональные площади пиков. На рис.6.1 представлена хроматограмма смеси из трех веществ. Вещество А не сорбируется поверхностью стационарной фазы. Стрелкой обозначен момент впуска смеси в поток газа-носителя у входа в колонку. Принципиальная схема газового хроматографа показана на рис.6.2. Проба анализируемого вещества подается в хроматографическую колонку 1 с помощью дозатора 2, через который пропускают газ-носитель. Обычно пробу вводят в поток газа-носителя шприцем. В колонке 1 компоненты пробы распределяются вдоль слоя сорбента, детектор 3 фиксирует концентрации выходящих из колонки компонентов в потоке газа-носителя. Сигнал детектора регистрируется самописцем 6.
Рис. 6.2. Схема газового хроматографа. 1 - хроматографическая колонка; 2 - дозатор; 3 - детектор; 4- баллон с газом-носителем; 5а - вентиль тонкой регулировки; 5б - манометр; 5в - пенометр; 6 -самописец; 7 - термостат.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 1267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.4 (0.009 с.) |

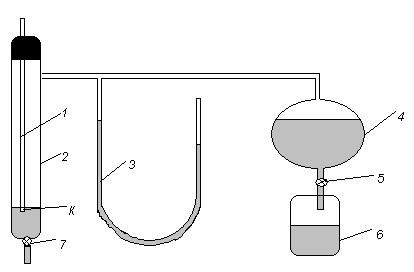 Прибор для определения поверхностного натяжения показан на рис.5.4.
Прибор для определения поверхностного натяжения показан на рис.5.4.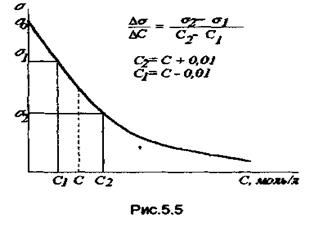
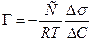 (5.7)
(5.7)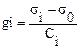 , где σi поверхностное натяжение раствора ПАВ с концентрацией Сi, σ0 - поверхностное натяжение воды.
, где σi поверхностное натяжение раствора ПАВ с концентрацией Сi, σ0 - поверхностное натяжение воды.