
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 12. Качественный и количественный анализ смеси углеводородов С помощью газовой хроматографии на колонке С апьезоном, нанесенном на хроматон.Содержание книги
Поиск на нашем сайте
Цель работы. 1. Провести качественный анализ углеводородов по временам удерживания, удерживаемым объемам и индексам Ковача. 2. Определить количественный состав контрольной смеси углеводородов. Условия опыта: Хроматограф ЛХМ-80 Сорбент - апьезон, нанесенный на хроматон. Газ-носитель - азот. Детектор - катарометр. Ток моста детектора 60 mА Температура детектора 150° С. Температура испарителя 150° С. Температура колонки 125° С. Порядок выполнения работы: 1. Измерить объемную скорость газа-носителя на выходе из колонки w с помощью пенометра. Для этого нажатием груши пенометра получить движущуюся пленку и измерить секундомером время t, за которое пленка пройдет заданный объём V, например, 10 мл. Для получения достаточной точности измерения время не должно быть меньше 30 сек. Измерения проводятся не менее 3 раз и усредняются. Результаты измерений записать в табл.6.1. Величину w рассчитать по формуле w = V /t (6.9) Значение скорости потока должно находиться в пределах от 15 до 22 мл/мин в каждой колонке. 2. Рассчитать объёмную скорость газа-носителя в колонке при 125° С (wиспр) по формуле (6.10) с учетом того, что измерение потока газа производится при комнатной температуре.
где Ткол - температура колонки, Tком - температура в комнате в градусах Кельвина. 3. Определить времена удерживания гексана, гептана, октана и нонана. Для этого микрошприцем набрать 1-2 мкл гексана так, чтобы в шприце не оставалось пузырьков воздуха. Включить тумблер "диаграмма" на самописце 6. Ввести пробу микрошприцем в колонку 1, включив секундомер в момент впуска вещества и отметив время выхода максимума пика. Аналогичные впуски повторить для гептана, октана и нонана. Результаты измерений записать в таблицу 6.2. ВНИМАНИЕ! Работа с микрошприцем требует внимания и аккуратности. Первую пробу вводить только после объяснения лаборанта. 4. Получить хроматограмму эквимолярной смеси углеводородов С6-С9, сделав впуск 1-2 мкл смеси. По мере выхода углеводородов в порядке возрастания их молекулярных весов записывать время выхода максимумов пиков tu. Повторить опыт еще 2-3 раза. Записать полученные tu в табл.6.2. 5. Определить время удерживания несорбирующегося газа - воздуха tu,air=t0 и записать его значение в таблицу 6.2. 6. Сделать 2 впуска контрольной смеси по 1-2 мкл и записать времена выхода максимумов пиков в табл.6.3. 7. Сделать впуск неизвестного вещества, предложенного преподавателем, определить время выхода tux и записать его в таблицу 6.2. I. Определение качественного состава смеси углеводородов а. по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов С6 –С9.
1. Сравнить времена, удерживания tu компонентов контрольной смеси (табл.6.3) с временами удерживания гексана, гептана, октана и нонана (табл.6.2). По совпадению величин tuсделать вывод о составе контрольной смеси. б. по индексам Ковача. 2. Рассчитать для каждого компонента эквимолярной смеси исправленное время удерживания tRno формуле (6.11) и результаты записать в таблицу 6.2. tR=tu- tu,air (6.11) З. По формуле (6.2) рассчитать VR, lgVR и записать эти результаты в табл.6.2. Построить график зависимости Ig VR от nc. Убедиться в линейности этой зависимости. 4. Рассчитать величину VR и IgVR неизвестного вещества и результаты записать в таблицу 6.2. 5. Определить индекс Ковача IХ неизвестного вещества графически и рассчитать по формуле (6.4). Полученные результаты записать в таблицу 6.3. 6. Сравнить рассчитанные IХ со справочными данными (взять у преподавателя) и определить неизвестное вещество. ΙΙ.Определение количественного состава контрольной смеси углеводородов в мольных процентах. 1. Определить площади пиков эквимолярной смеси методом треугольника по формуле S=hσ (6.12) где h - высота пика, а σ- ширина его на половине высоты. Отсчет высот пиков производится от положения базовой линии, экстраполированной в пределы записанного пика, как показано на рис.6.4. Определенные таким образом площади записать в табл.6.4.
2. Рассчитать относительные мольные поправочные коэффициенты для каждого впуска эквимолярной смеси, приняв за стандарт н-гексан по формуле Ki 0=Sst/Si (6.13) Записать рассчитанные Kio в табл.6.4 и найти их средние значения. 3. Определить площади пиков компонентов контрольной смеси. 4. Рассчитать мольный процент каждого компонента смеси по формуле (6.7). Результаты записать в табл.6.4.
Таблица 6.1 Определение объемной скорости газа-носителя.
Таблица 6.2 Времена выхода tu и удерживаемые объемы н-алканов С6 - С9 эквимолярной смеси, неизвестного вещества и воздуха.
Таблица 6.3 Качественный анализ неизвестных веществ по временам удерживания и индексам Ковача.
Таблица 6.4 Определение количественного состава контрольной смеси.
Контрольные вопросы Перед выполнением работы 1. Цель данной работы. 2. Нарисуйте схему газового хроматографа. 3. Назовите основные части хроматографической установки. 4. Какие параметры необходимо определить для качественного анализа смеси неизвестного состава? 5. Зачем делают импульсный ввод воздуха? 6. Как определить, какой пик хроматограммы соответствует каждому из четырех углеводородов стандартной смеси? 7. Что является количественной характеристикой вещества при хроматографическом анализе? 8. Какие параметры необходимо знать для определения количественного состава смеси веществ? 9. Как определить площадь пика на хроматограмме? 10. Как определить относительные мольные поправочные коэффициенты веществ по смеси этих веществ известного состава? К защите работы 1. Как происходит разделение компонентов смеси в хроматографическом опыте? 2. Что является качественной характеристикой данного вещества в хроматографическом анализе? 3. Какие зависимости параметров удерживания наблюдаются в гомологических рядах углеводородов? 4. Как определить количество выходящего из колонки вещества по площади его пика на хроматограмме? 5. Дайте определение относительному поправочному коэффициенту. ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика изучает скорости протекания химических процессов, их зависимость от различных факторов: концентрации реагирующих веществ, температуры, давления, присутствия катализаторов. Скоростью химической реакции называется изменение количества реагирующего вещества в единицу времени в единице объёма. Средняя скорость реакции
где n1 и n2 - количество молей реагирующего вещества в моменты времени t1 и t2, соответственно, V- объём системы. Если объем системы не меняется в ходе реакции, то
Скорость реакции всегда положительна, поэтому знак "минус" в формуле (7.1) ставят, если скорость реакции определяют по изменению количества исходного вещества, которое расходуется в ходе процесса. Истинной скоростью реакции v в данный момент времени называется изменение количества реагирующего вещества за бесконечно малый промежуток времени, т.е. производная концентрации С по времени t. v = ±dC/dt (7.2) Скорость химического процесса можно определять по любому исходному или любому конечному веществу. Если в уравнении реакции не все стехиометрические коэффициенты равны единице, то необходимо указать, по изменению концентрации какого вещества определяется скорость. Например, для реакции n A + m B = D (7.3) можно записать
Скорость элементарной реакции, протекающей в одну стадию, механизм которой передается стехиометрическим уравнением, пропорциональна концентрациям исходных веществ в степенях, равных стехиометрическим коэффициентам (закон действия масс): v= k Can Cbm (7.4) Коэффициент k называется константой скорости реакции (или удельной скоростью реакции) и численно равен скорости реакции при концентрациях всех реагирующих веществ, равных единице. Константа скорости зависит от природы реагирующих веществ, температуры, катализатора и его концентрации, от среды, в которой протекает реакция. Величины n и m называются частными порядками реакции по веществам А и В, соответственно. Порядок реакции в целом равен сумме порядков реакции по всем реагирующим веществам, т.е. (n + m). Если реакция протекает в несколько стадий (сложная реакция), то соотношение (7.4) выполняется для каждой стадии. Очень часто скорость сложных химических реакций описывается уравнением, аналогичным уравнению (7.4), однако в этом случае величины n и m не равны стехиометрическим коэффициентам. Они могут быть целыми, дробными, положительными и отрицательными. Для характеристики элементарных реакций используют понятие молекулярности реакции, равной числу реагирующих молекул. По числу молекул, участвующих в элементарном акте химического превращения, различают реакции моно-, двух- и трехмолекулярные. Вероятность одновременного столкновения нескольких молекул определенного вида ничтожно мала, поэтому трехмолекулярные реакции немногочисленны. Реакций более высокой молекулярности неизвестно. Для элементарной реакции порядок и молекулярность совпадают. Рассмотрим простейшие кинетические уравнения реакций первого и второго порядков. Скорость реакций первого порядка в каждый момент времени пропорциональна концентрации реагирующего вещества: -dC/dt = kC (7.5) Интегрирование уравнения (7.5) дает lnC0/ C = kt (7.6) где С0 - исходная концентрация вещества, С - концентрация вещества в момент времени t. Видно, что константа скорости имеет размерность, обратную времени (с-1), и не зависит от единиц концентрации. Для реакций первого порядка характерна, как видно из уравнения (7.6), линейная зависимость ln С от времени t. Время полупревращения t1/2, за которое прореагирует половина исходного вещества, можно определить, подставляя в уравнение (7.6) значение С = С0/2:
Скорость реакций второго порядка описывается уравнением
v = kCaCb, при Са = Сb, -dC / dt = k C2 (7.8) Интегрируя это уравнение, получим 1/C-1/C0 = k t (7.9) Размерность константы скорости в этом случае зависит от единиц концентрации. Если время выражено в секундах, а концентрация - в моль/л, то размерность к - л/моль с. Из уравнения (7.9) видно, что для реакций второго порядка характерна линейная зависимость 1/С от времени t. Время полупревращения в случае реакций второго порядка обратно пропорционально начальной концентрации вещества:
Опыт показывает, что в подавляющем большинстве случаев скорость реакции увеличивается с ростом температуры. Обычно при повышении температуры на 10 С скорость гомогенной реакции возрастает в 2 - 4 раза (приближенное правило Вант-Гоффа). Температурный коэффициент реакции γ:
Более точную зависимость константы скорости к от температуры передает эмпирическое уравнение Аррениуса
где к0 - предэкспоненциальный множитель, Е- энергия активации реакции, показывающая тот необходимый избыток энергии (по сравнению со средним уровнем), которым должны обладать молекулы, чтобы реакция была возможной. Уравнение (7.12) можно записать в логарифмической форме:
Согласно этому уравнению, график зависимости lg к от 1/Т должен представлять прямую линию. Используя эту зависимость можно из экспериментальных данных определить величину к 0 и энергию активации реакции Е. Работа 13. Изучение кинетики гомогенного каталитического разложения Н2О2. Перекись водорода в водных растворах самопроизвольно медленно разлагается по уравнению: 2Н2О2→ 2Н2О + О2 При температурах близких к комнатной, реакция разложения заметно протекает лишь в присутствии катализаторов. В зависимости от фазового состояния катализатора и реагента катализ подразделяют на гомогенный и гетерогенный. Гомогенно-каталитическое разложение перекиси водорода в растворе под действием ионов Cr2O72- происходит в две стадии. В первой обратимой реакции образуются ионы промежуточного соединения Cr2O92-, которые далее необратимо распадаются с выделением кислорода и исходного Cr2O72-:
K1 1. 2H2O2 + Cr2O72- = Cr2O92- +2H2O К2 2. Cr2O92- → Cr2O72- + O2 Полагая, что лимитирующей стадией является относительно медленный распад иона промежуточного соединения Сг2O92-, общую скорость процесса считают пропорциональной концентрации этих ионов.
где к2 - константа скорости второй стадии реакции. Концентрацию ионов промежуточного соединения можно найти, используя константу равновесия первой реакции К1.
где К1 – константа равновесия,
Вода находится в большом избытке, и её концентрацию можно считать постоянной. Выразив концентрацию ионов Cr2O92- промежуточного соединения из (7.14') и подставив её в (7.14), получим
Из уравнения (7.15) следует, во-первых, что скорость процесса пропорциональна начальной концентрации катализатора, и, во-вторых, что в общем случае порядок реакции по Н2О2 дробный и может изменяться от 0 до 2. Действительно, если равновесие сдвинуто в сторону образования промежуточного продукта, т.е. в уравнении (7.15)
В случае, когда
и порядок реакции по перекиси водорода будет равен 2. Поскольку сдвиг равновесия в ту или иную сторону зависит от температуры, порядок реакции разложения перекиси водорода изменяется с температурой. Уравнение (7.15) преобразуют в линейную форму, взяв обратное значение скорости
(7.16)
Из графика в координатах А. Порядок подготовки установки к работе и работа на ней. Реакция разложения Н202 сопровождается выделением кислорода. Объем его, пропорциональный количеству разложившейся перекиси, измеряют в приборе, схема которого показана на рис.7.1
Прибор состоит из реакционного сосуда 3, соединенного резиновой трубкой с бюреткой 2 и уравнительной склянкой 1. Уравнительная склянка нужна для того, чтобы измерять объем выделившегося кислорода всегда при одном и том же давлении (атмосферном). Прежде, чем приступить к проведению кинетических опытов, необходимо: 1. Определить титрованием перманганатом калия концентрацию рабочего раствора перекиси водорода. Для этого в две колбочки налить пипеткой 2 или 3 мл рабочего раствора H2O2 и 1-2 мл 20% раствора серной кислоты. Титровать раствором перманганата калия 0,1 моль/л до появления розового окрашивания. При титровании протекает реакция
2. Подготовить установку к работе. Для этого установить с помощью уравнительной склянки уровень жидкости в бюретке на ноль (в этот момент реактор должен быть открыт). 3. Проверить установку на герметичность. Закрыть пробкой реактор. Затем опустить уравнительную склянку ниже середины шкалы бюретки. Уровень воды в бюретке при этом опустится и установится на некотором делении. Если это положение не изменится в течение 3 минут, установку можно считать герметичной. Порядок проведения кинетического опыта: 1. В реактор залить 15 мл приготовленного раствора перекиси водорода заданной концентрации и уравнять мениски жидкости в бюретке и уравнительной склянке. 2. Приготовить в стеклянном стаканчике 2 мл раствора К2Сг207 заданной концентрации. Влить в реактор раствор катализатора, быстро закрыть его пробкой и включить секундомер. 3. 6.Через каждую минуту (а в случае быстрой реакции через 30 сек) измерять объем выделившегося кислорода до тех пор, пока в течение минимум 5 мин объём кислорода не будет больше увеличиваться, что свидетельствует об окончании реакции. Все отсчеты производить при выровненных менисках в бюретке и уравнительной склянке. Результаты измерений записывать в таблицу 7.1. Таблица 7.1 Зависимость количества образовавшегося кислорода от времени. Температура……… Объем раствора Vp……………..
4. Построить кинетические кривые в координатах VО2 -t. 5. Вылить раствор из реактора, промыть его и приготовить всё к следующему опыту, согласно предложенному варианту. Варианты задания и методика расчетов. I. Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора К2Сг207 . Цель работы: Экспериментально определить влияние концентрации катализатора на скорость реакции разложения перекиси водорода. Исходные данные: концентрация Н2О2 - 0,15 моль/л, концентрации К2Сг207 - 0,02; 0,04; 0,06; 0,08 моль/л, температура – комнатная. Порядок проведения работы: 1. Подготовить реактор к работе, как описано выше в п.п.А.1-3. 2. Провести кинетический опыт (см. п.п.А.4-7) и получить зависимость количества выделившегося кислорода от времени. Результаты записать в таблицу 7.1. 3. Провести аналогичные измерения для разных исходных концентраций катализатора. Количество перекиси водорода во всех опытах не изменяется. 4. Рассчитать максимальный объём кислорода (в мл), который может выделиться при полном разложении 15 мл Н202 данной концентрации по формуле:
где R = 0,082 л атм/град моль
- парциальное давление кислорода, мм.рт.ст., Р = Ро2 + Рн2о, Р-атмосферное давление. т.к. Рн2о мало (Рн2о =0,02 атм.), считаем Ро2 = 1атм. Т- температура в помещении в К; Vн2о2 - объём перекиси водорода в реакторе в мл; С0н2о2 - исходная концентрация перекиси водорода, моль/л. 5..Рассчитать объем кислорода, который выделяется при разложении половины исходного количества Н202 V1/2 = 1 / 2Vmax 02. 6..Из графиков для каждой кинетической кривой определить время полупревращения t]/2 и величину ΔVо2/Δt.
где V2O2 и V1o2 - объем кислорода, выделившийся в момент времени t1/2+0,5 и t1/2-0,5. 7. Рассчитать скорость реакции w 1/2в момент времени tl/2 по формуле (7.19). Результаты вычислений записать в таблицу 7.2. Построить график зависимости w1/2 -
Таблица7.2 Зависимость скорости реакции разложения Н2О2 от концентрации катализатора Vmax02 =......... ………………….. V1/2 =…………………………….
II. Определение константы равновесия К1 и константы скорости k 2 реакции разложения перекиси водорода. Цель работы: Из экспериментальных кинетических кривых определить константу равновесия К1 и константу скорости k2 реакции разложения перекиси водорода. Для расчета константы равновесия К1 и константы скорости k2 реакции используют уравнение (7.15). 1. Провести кинетический опыт, как описано в п.п.А.1-7 (концентрации перекиси водорода и катализатора указываются преподавателем). Получить зависимость количества выделившегося кислорода от времени. Результаты записать в таблицу 7.1. 2. Построить кинетическую кривую в координатах V02 -t. Из кривой для 6-7 значений tграфическим дифференцированием определить величину ΔVо 2 /Δt 3. По формуле (7.19) вычислить скорость реакции w = -ΔCH202/Δt. 4. По формуле (7.17) рассчитать максимальный объем кислорода Vmaxо 2,который может выделиться при полном разложении Н202 заданной концентрации. 5. Учитывая, что концентрация перекиси водорода в момент времени t пропорциональна величине Vmaxо 2 - V o2 рассчитать концентрацию Н202по формуле (7.20)
6. Результаты вычислений записать в таблицу 7.3. Построить зависимость 1/ w от 1/С2н2о2. Тангенс угла наклона прямой позволяет найти произведение
Таблица7.3 Определение величин К1и к2реакции разложения Н202. C0н2о2 = ………………VH2o2 = ……………………….....
Vp = ………………….Vmaxо 2 =………………………….
K1 =.... ………….. k2 =... ……………. III. Определение порядка реакции. Порядок реакции можно определить по времени полупревращения t1/2 перекиси водорода. Скорость разложения Н2О2 описывается уравнением:
Интегрируя это выражение, получим
При t = t1/2 C = С°/2, тогда
Если имеются значения величины tl/2 для различных исходных концентраций С0 перекиси водорода, то в координатах lgt1/2 — lgC° получают линейную зависимость, позволяющую определить порядок реакции n. Цель работы: Экспериментально определить порядок реакции разложения перекиси водорода. Исходные данные: концентрация Н202 - 0,3 моль/л концентрация К2Сг2О7 - 0,02 моль/л 1. Провести 4 кинетических опыта, как описано в п.п.А.1-7, и получить зависимость объема выделившегося кислорода от времени для растворов с различной исходной концентрацией Н2Ог и одинаковой концентрацией катализатора. Составы реакционных смесей указаны в таблице 7.4. Таблица7.4. Определение порядка реакции по времени полупревращения H2O2.
2. Рассчитать исходные концентрации Н202 в реакторе Сp0н2о2, величины Vmaxо2, V1/2=1/2 Vmaxо2, как описано в задании I (п.п.5-6). Из графика определить время полупревращения tl/2. Результаты записать в таблицу 7.4. 3. Построить линейную зависимость lgСp0н2о2 – lgt1/2, определить тангенс угла наклона прямой tgα = n-1 и вычислить величину порядка реакции n. Контрольные вопросы Перед выполнением работы: 1. Расскажите последовательность подготовки системы к работе и порядок проведения опыта. 2. Какие концентрации рабочих растворов Н2О2 и растворовкатализатора следует приготовить для работы? 3. Как проверить установку на герметичность? 4. Как рассчитать максимально возможный объём кислорода, который может выделиться в результате разложения Н202? 5. Запишите реакции, протекающие в системе при разложении перекиси водорода раствором бихромата калия. 6. Как определить текущую концентрацию Н2О2? 7. Как рассчитать ΔVо2 / Δt методом графического дифференцирования? 8. Как определить константу скорости и константу равновесия реакции разложения перекиси из экспериментальных данных? К защите работы: 1. Дайте определение скорости реакции, порядка реакции. Поясните физический смысл константы скорости реакции. 2. Запишите кинетические уравнения необратимых реакций нулевого и второго порядка. 3. Запишите механизм разложения перекиси водорода в присутствии ионов Cr2O72-. Каковы условия проведения реакции разложения Н202 в присутствии бихромата калия по а) нулевому, б) второму порядку? 4. Объясните последовательность выполненных вами расчетов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 1002; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.235.195 (0.015 с.) |

 (6.10)
(6.10)
 воздух
воздух

 равна
равна (7.1)
(7.1) (7.1')
(7.1')
 (7.7)
(7.7) (7.10)
(7.10) (7.11)
(7.11) (7.12)
(7.12) (7.13)
(7.13) (7.14)
(7.14) (7.14')
(7.14')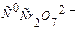 исходная концентрация катализатора,
исходная концентрация катализатора, - равновесная концентрация катали затора,
- равновесная концентрация катали затора,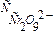 - концентрация промежуточного продукта,
- концентрация промежуточного продукта, - равновесная концентрация перекиси водорода.
- равновесная концентрация перекиси водорода.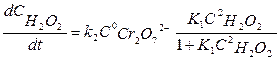 (7.15)
(7.15) ››1, то порядок реакции по перекиси водорода равен нулю и скорость реакции равна
››1, то порядок реакции по перекиси водорода равен нулю и скорость реакции равна
 ‹‹1, т.е. равновесие сдвинуто в сторону исходного вещества, скорость реакции
‹‹1, т.е. равновесие сдвинуто в сторону исходного вещества, скорость реакции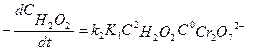

 по тангенсу угла наклона прямой при известной исходной концентрации катализатора
по тангенсу угла наклона прямой при известной исходной концентрации катализатора 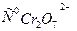 находят произведение k 2К1, а по отрезку, отсекаемому на оси ординат, значение k2.
находят произведение k 2К1, а по отрезку, отсекаемому на оси ординат, значение k2.
 2MnO4- + 6H+ + 5Н202 2Мn2+ + 8Н20 + 502.
2MnO4- + 6H+ + 5Н202 2Мn2+ + 8Н20 + 502.
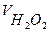
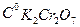

 (7.17)
(7.17)
 (7.18)
(7.18) .
. (7.19)
(7.19) (7.20)
(7.20) , а отрезок, отсекаемый на оси ординат, значение
, а отрезок, отсекаемый на оси ординат, значение  , см уравнение (7.16). Из найденных произведений, зная концентрацию катализатора, найти величины К1 и k2.
, см уравнение (7.16). Из найденных произведений, зная концентрацию катализатора, найти величины К1 и k2.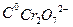 =…………
=…………  =…………………
=………………… (7.21)
(7.21)
 или
или (7.22)
(7.22)



