
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 7. Измерение ЭДС гальванического элемента.
Цель работы: 1. Измерить ЭДС Cu-Zn гальванического элемента и электродные потенциалы отдельных электродов, сравнить ЭДС Cu-Zn элемента с вычисленной по значениям измеренных электродных потенциалов и по уравнению Нернста. 2. Измерить ЭДС концентрационного элемента и сравнить ее с вычисленной по уравнению Нернста. Порядок выполнения работы: I. Измерение ЭДС Cu-Zn гальванического элемента потенциометром. 1. Составить для работы медно-цинковый гальванический элемент. С этой целью налить в сосуды с медным и цинковым электродами растворы CuSO4 и ZnSO4 , соответственно. Стеклянный соединительный мостик заполнить насыщенным раствором KCl, избегая появления пузырьков. В соединительную пробирку налить насыщенный раствор КСl. 2. Подключить медно-цинковый элемент к потенциометр:медный электрод подключит к клемме «+» потенциометра, цинковый к «-» 3. Измерить ЭДС Cu-Zn элемента с помощью потенциометра. Результаты измерений записать в таблицу 4.1. 3. Вычислить ЭДС Cu-Zn элемента по формуле (4.20) и результат вычислений записать в таблицу 4.1.
Таблица 4.1 Определение ЭДС Cu-Zn элемента.
E0Cu2+/ Cu = …………………….. E0Zn2+/ Zn=................ E0г.э. =.........................
II. Определение потенциалов Zn- и Си - электродов. 1. Определить электродный потенциал Zn -электрода. Для этого составить гальванический элемент из цинкового и хлорсеребряного электродов и с помощью потенциометра измерить его ЭДС. Записать в тетради электродные реакции, протекающие в этом элементе. Zn │ ZnSO4 ││Klнасыщ │ AgCl │ Ag Величину потенциала Zn -электрода рассчитать по формуле (4.21). Значение потенциала хлорсеребряного электрода ЕАg найти по формуле (4.18). Eг.э. =EAg – EZn и EZn = EAg - Eг.э. (4.21) 2. Определить потенциал Cu -электрода, составив гальванический элемент из медного и хлорсеребряного электродов и измерив его ЭДС. Записать в тетради электродные реакции, протекающие в этом элементе.
Ag │ AgCl │ Klнасыщ ││ CuSO4 │ Cu 3. Рассчитать электродный потенциал Cu -электрода, учитывая, что Cu -электрод является положительным: Eг.э. =EСu – EAg и ECu = Eг.э. + EAg
4. Вычислить по формуле Нернста (4.15) электродные потенциалы Zn- и Си- электродов. Значения стандартных потенциалов и коэффициентов активности взять из справочных таблиц. Результаты вычислений записать в таблицу 4. 2.
Таблица 4.2 Определение электродных потенциалов Zn- и Сu- электродов. t0C………… EAg………………………………
III. Измерение ЭДС концентрационного элемента. 1. Подготовить для работы один из двух указанных ниже концентрационных гальванических элементов (-)Zn│ZnSO4││ZnSO4│Zn(+) или С1 С2 (-)Cu │CuSO4│CuSO4│Cu(+) С1 С2 с концентрациями солей С1= 0,1 моль/л и С2 = 1,0 моль/л, подключить элемент к потенциометру и измерить его ЭДС. 2.Рассчитать ЭДС концентрационного элемента по формуле:
Результаты записать в таблицу 4.3 Таблица 4.3
Контрольные вопросы
Перед выполнением работы: 1. Какова цель данной работы? 2. Как производится измерение ЭДС медно-цинкового и концентрационного гальванических элементов? 3. Как измерить потенциалы Си- и Zn - электродов? 4. Какие электроды используются в данной работе? 5. Запишите схемы гальванических элементов, используемых в работе. 6. Как вычислить ЭДС медно-цинкового гальванического элемента по уравнению Нернста? 7. Как вычислить потенциалы Си- и Zn - электродов? К защите работы: 1. Поясните термины: электрод, электродная реакция, гальванический элемент, ЭДС, электродный потенциал, стандартный электродный потенциал. 2. Если в гальваническом элементе протекает самопроизвольный процесс, а) на каком электроде происходит окисление; б) какой из электродов считается отрицательным; в) каков знак ЭДС.; г) каков знак изменения энергии Гиббса данной реакции? 3. Запишите электродные реакции для используемых в работе гальванических элементов.
4. Как по величине электродных потенциалов рассчитать ЭДС элемента определить направление реакции, протекающей в этом элементе? 5. Какие электроды используют в качестве электродов сравнения? 6. Какой элемент называется концентрационным?
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 779; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.74.227 (0.008 с.) |
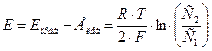 для комнатной температуры
для комнатной температуры


