
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Увеличение температуры реакции на 10 градусов влечет повышение скорости реакции в 2 – 4 раза.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пример 3. Во сколько раз увеличится скорость реакции при повышении температуры процесса с 20 до 40оС, если температурный коэффициент скорости реакции равен 3? Решение: Более строгая математическая зависимость скорости реакции от температуры предложена Сванте Аррениусом. Она описывает связь между константой скорости химической реакции, температурой процесса и энергией активации. Эмпирическое уравнение Аррениуса (1889 г.): Уравнение Аррениуса по форме напоминает уравнение распределения молекул по скоростям Больцмана. Максимум на кривой соответствует энергии кратковременно существующего активированного комплекса, т. е. молекулы, в которой одна из связей находится в процессе разрушения или образования. Энергию активации можно рассчитать, зная константы скорости химической реакции при двух температурах:
Тангенс угла наклона прямой к оси абсцисс будет равен Еа/R, откуда легко вычислить значение энергии активации. (Представленная зависимость получается после дифференцирования уравнения Аррениуса в логарифмической форме по Т с последующим интегрированием между значениями Т1 и Т2) Пример 4: Рассчитайте энергию активации для реакции, скорость которой удваивается при переходе от 300 к 310 К. (R = 1,987 ккал/моль ×К) Решение: Величину энергии активации можно определить графически, построив график зависимости lg k = f(1/T), представляющий собой прямую линию. Задачи для самостоятельного решения 1. В реакции А +2В = С повышение концентрации вещества В в 2 раза вызвало повышение скорости реакции в 2,25 раз. Каков истинный порядок реакции по веществу В и общий порядок? 2. В реакции Н2 + Вг2 = 2НВг при повышении концентрации брома в 3 раза скорость реакции возросла в 3,165 раза. Каковы порядок реакции по брому и общий порядок? 3. Если прямая реакция экзотермическая, а обратная эндотермическая, то какая из них характеризуется более высоким значением энергии активации? (Проиллюстрируйте свое решение). 4. На сколько градусов требуется повысить температуру системы, чтобы скорость реакции, протекающей в ней, увеличилась в 30 раз. Температурный коэффициент скорости реакции равен 2,5. 5. При повышении температуры реакции на 50оС скорость реакции увеличилась в 525 раз. Найти температурный коэффициент скорости реакции. 6. Энергия активации некоторой реакции в отсутствии катализатора равна 80 кДж/моль, а в присутствии катализатора она понижается до 53 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора при 20 оС? 7. Рассчитайте время полураспада и среднее время жизни молекулы (1/k) для некоторой реакции первого порядка, константа скорости которой 94,2 с -1. 8. При увеличении температуры от 0 до 13 оС скорость некоторой реакции возросла в 2,97 раза. Чему равна энергия активации этой реакции? 9. Пользуясь уравнением Аррениуса, оцените диапазон значений энергии активации, при которых будет справедливо правило Вант-Гоффа для комнатной температуры 298 К. 10. Энергия активации некоторой реакции в 3 раза больше, чем энергия активации другой реакции. При нагревании от Т1 до Т2 константа скорости второй реакции увеличилась в Х раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от Т1 до Т2? Задание для самостоятельной работы по теме «Химическая кинетика»
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1356; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.67.189 (0.007 с.) |

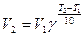 , где γ – температурный коэффициент скорости реакции.
, где γ – температурный коэффициент скорости реакции.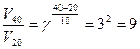 Скорость возрастет в 9 раз.
Скорость возрастет в 9 раз.
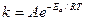 , где k – константа скорости химической реакции при температуре Т, А – константа, зависящая от частоты соударения определенным образом ориентированных в пространстве частиц, Еа – энергия активации. Это энергия, которой должны обладать молекулы, чтобы прореагировать. Для большинства реакций энергия активации лежит в интервале 15 – 60 ккал/моль, что соответствует энергиям химических связей.
, где k – константа скорости химической реакции при температуре Т, А – константа, зависящая от частоты соударения определенным образом ориентированных в пространстве частиц, Еа – энергия активации. Это энергия, которой должны обладать молекулы, чтобы прореагировать. Для большинства реакций энергия активации лежит в интервале 15 – 60 ккал/моль, что соответствует энергиям химических связей.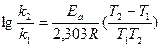
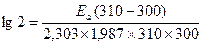 Е а = 12,8 ккал/моль
Е а = 12,8 ккал/моль


