
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетическая теория газов и основные газовые законы
В основе кинетической теории газов лежит понятие «идеальный газ». Это упрощенная математическая модель, пользуясь которой можно объяснить такие понятия, как давление газа, взаимодиффузия, эффузия и т. д. Понятие идеальный газ предполагает: - пренебрежимо малый объём частиц, - хаотическое беспрерывное движение частиц, - отсутствие взаимодействия между частицами, - идеально упругие столкновения, не ведущие к потере кинетической энергии. Согласно теории средняя кинетическая энергия частиц в газообразном состоянии пропорциональна температуре по абсолютной шкале Кельвина. Основными параметрами, описывающими состояние газа, являются объём (V), температура (Т) и давление (Р), связанные между собой эмпирическими зависимостями - газовыми законами. Закон Бойля- Мариотта: при Т = соnst давление данной массы газа обратно пропорционально его объёму:
Закон Шарля и Гей-Люссака: при р = const объём газа прямо пропорционален абсолютной температуре:
Закон (гипотеза) Авогадро: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Следствие №1 из гипотезы Авогадро: Одинаковое число молекул разных газов при одинаковых условиях занимает одинаковый объем. Следствие №2 из гипотезы Авогадро: Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее или легче другого: При решении конкретных физико-химических задач приходится сопоставлять результаты экспериментов, приводя их к единому «химическому масштабу». Таким масштабом являются «нормальные условия», которым отвечает температура, равная 0оС (273,15 К) и давление, равное 1 атмосфере (1,01325·105 Па или 760 мм рт. ст.). В таких условиях 1 моль идеального газа (6,02 1023 молекул) занимает объем 22,4 л (22,4 10-3 м3) Объём газа, его давление и абсолютная температура связаны между собой уравнением, объединяющим законы Бойля - Мариотта и Гей-Люссака:
где Р0, V0 и Т0- параметры газа при нормальных условиях: Привести объём газа к нормальным условиям – это значит пересчитать его объём при заданных условиях на объём при нормальных условиях:
Произведение постоянных величин P0V0/T0обозначается буквой R. Это универсальная газовая постоянная. В системе СИ она имеет размерность:
Если давление газа измерено в атмосферах, а объем в литрах, то численное значение R = 0,082 л атм/моль К. Физический смысл универсальной газовой постоянной: - это энергия, которую необходимо затратить, чтобы повысить температуру 1 кмоль газа на 1оС. При измерении объема в мл, а давления в миллиметрах ртутного столба значение универсальной газовой постоянной R = 62 360 мл мм рт. ст./моль К Таким образом, для 1 кмоль газа pV=RT, для n кмоль газа: pV= nRT (1.6) Это выражение известно как уравнение Менделеева - Клайперона или уравнение состояния идеального газа. Способы определения молекулярной массы газообразных веществ А) по плотности газообразного вещества: Плотность газа Пользуясь уравнением состояния идеального газа (1.6), можно записать:
Б) по относительной плотности газа: Из закона Авогадро следует, что массы двух одинаковых объёмов различных газов (при одинаковых температуре и давлении) будут относиться, как их молекулярные массы:
Отношение
Следовательно,
В) эвдиометрическим методом: //Эвдиометрия- метод определения формулы газа по сжиганию в избытке кислорода и анализу конечных продуктов//.
Пример 1. 10см 3 газообразного углеводорода С3НХ взаимодействуют с избытком кислорода при 110°С. В результате объём конечных продуктов увеличился на 5 см3. Найти углеводород. Решение: С3НХ + (3 + х/4) О2® 3СО2 + х /2 Н2О (г.) (г.) (г.) (пар) V, cм 3 : 10 30 + 2,5Х 30 5Х По условию задачи: V(начальн.) + 5 = V(конечн.), тогда 10 + 30 + 2,5Х + 5 = 30 + 5Х, откуда Х = 6, следовательно, искомый углеводород – С3Н6 (пропен или циклопропан) Задачи для самостоятельного решения 1. Давление газа, занимающего при некоторой температуре объём 0,3 м³, равно 101,5 кПа. Каким будет давление, если при той же температуре увеличить объём газа до 0,5 м³? 2. При 17ºС объём газа 440 л. Какой объём займёт тот же газ при 47ºС (Р= const)? 3. В баллоне при 20ºС находится газ под давлением 4,053 МПа (40 атм.). Каким станет давлением, если температура повышается до 30ºС?
4. Приведите к нормальным условиям 608 л газа, имеющего температуру 91ºС и давление 98642 Па. 5. При 25ºС и 85312 Па газ занимает объём 820 мл. Вычислить объём газа при нормальных условиях. 6. Масса 1л газа (н.у.) составляет 1,25 г. Вычислите молекулярную массу газа. 7. Вычислите массу 0,25 л неона при 90ºС и 101308 Па. 8. Какой объем занимает газ массой 1 г при температуре 27оС и давлении 1×105, если его плотность по водороду равна 32? Какие газы тяжелее, а какие легче воздуха: NO2, CO, Cl2, CH4. Во сколько раз? 9. Некоторое вещество в парообразном состоянии, взятое массой 36,95 г, занимает объем 16,4 л при температуре 127оС и давлении 0,96×105. Чему равна молярная масса этого вещества? 10. Масса 87 мл паров некоторого вещества при 62°С и 101 041 Па равна 0,24 г. Найти его молярную массу. 11. Взрыв 10 см³ газообразного углеводорода СхНу с избытком кислорода сопровождается сжатием на 25 см³. (Все объёмы измерены при комнатной температуре и давлении!). Обработка продуктов реакции раствором NaOH уменьшила объём на 20 см³. Найти СхНу. 12. Сжигание 10 см³ СхНу в 50 см³ кислорода (избыток) сопровождается сжатием газов охлаждённых до 20ºС, на 20 см³. Последующее уменьшение объёма на 20 см³ наступило при обработке оставшихся газов раствором NaOH. Найти СхНу. 13. Циан - соединение углерода с азотом. Найдите его формулу, если при сжигании 250 см³ циана в избытке кислорода образовалось 500 см³ СО2.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 456; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.186.164 (0.01 с.) |
 или РV = const (1.1)
или РV = const (1.1) или V/T= const (1.2)
или V/T= const (1.2) (1.3)
(1.3) (1.4)
(1.4) (1.5)
(1.5)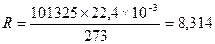 Дж/моль К или 8,314 103 Дж/кмоль К
Дж/моль К или 8,314 103 Дж/кмоль К ; для 1моль газа при нормальных условиях m =М г/моль; V= 22,4, л/моль; тогда
; для 1моль газа при нормальных условиях m =М г/моль; V= 22,4, л/моль; тогда 
 , г/л
, г/л или
или  (1.7)
(1.7) (1.8)
(1.8) называется относительной плотностью первого газа по второму и обозначается D:
называется относительной плотностью первого газа по второму и обозначается D: или
или 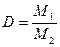 (1.9)
(1.9)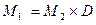 (1.10)
(1.10)


