
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опорный конспект №2. Тема: «Моль. Эквивалент»Содержание книги
Поиск на нашем сайте
Понятие «эквивалент» относится, пожалуй, к наиболее сложным для осмысления понятиям общей химии. Оно значительно эволюционировало по мере развития химической науки. Если первоначально эквивалент определялся для конкретного элемента в соединении как молекулярная масса, деленная на валентность, то позже это понятие стало охватывать поведение простых и сложных веществ в реакциях разного типа, в том числе и окислительно - восстановительных. Современная трактовка понятия связана, прежде всего, с переходом к молярным величинам, относящимся к количеству вещества в 1 моль, а также применению его к ионным соединениям. Ключевыми понятиями всех стехиометрических расчетов являются понятия «моль» и «эквивалент». //☺ Стехиометрия – область химии, изучающая количественный состав вещества, а также количественные изменения, происходящие с ним в ходе химических реакций //
Элементарные химические частицы должны быть указаны конкретно и могут представлять собой: атомы, молекулы, ионы, радикалы, формульные единицы вещества и пр. Количество вещества NА =6,022×1023 моль-1. Соотношения между числом частиц
n - N - m - V
Рис.1. Схема, иллюстрирующая взаимосвязи между основными параметрами: количеством вещества, массой, объемом и числом частиц.
Пользуясь представленной схемой, как картой, легко найти путь от одного параметра, описывающего вещество, к другому.
Задачи для самостоятельного решения //☺ Количество вещества – моль - пропорционально числу конкретно указанных элементарных химических частиц. Коэффициент пропорциональности - постоянная Авогадро. Можно сказать проще: «моль» - просто средство подсчитывать атомы и молекулы порциями по 6,02×1023 частиц.// 1. Вычислите постоянную Авогадро, зная, что число Фарадея равно 96487 Кл, а заряд электрона 1,6022 ×10-19 Кл.
2. Из радия массой 1 г за 1 сек выделяется 5,03 ×10-9 см3 Не (н. у.). По сцинтилляциям на экране, покрытом сульфидом цинка, определено, что в этом объеме содержится 13,6× 1010 α – частиц. Рассчитайте по этим данным постоянную Авогадро. //☺ Термин «молярная величина» означает величину, отнесенную к 1 моль вещества: молярная масса, молярный объем, молярная теплоемкость и т. д.// 3. Как перейти от энергии одной частицы к энергии 1 моль частиц? Запишите значение энергии 3,37×10-19Дж в кДж/моль. 4. Заряд 1 моль электронов принимают равным 1F (Фарадей). Рассчитайте значение 1F, если заряд электрона равен 1,6022 ×10-19 Кл. 5. Масса 1 молекулы белого фосфора 2,06×10-22 г. Установите истинную формулу молекулы фосфора. 6. Наиболее точное взвешивание можно производить с точностью до 10-10 г. Сколько атомов золота содержится в образце такой массы?
В 1792 – 1806 г.г. И. В. Рихтер опытным (эмпирическим) путем установил следующую закономерность: «Вещества вступают в химические реакции в строго определенных весовых количествах». Так, например, на 1 весовую часть водорода приходится 8 весовых частей кислорода, 3 весовые части углерода и т. д. Масса химического элемента, которая способна соединяться с одной весовой частью водорода или восемью весовыми частями кислорода была позже (В. Волластон) названа эквивалентом. //☺ Эквивалент – равноценность, равнозначность// Это был серьезный шаг на пути к установлению химических формул веществ, осмыслению понятия «соединительная сила» или «валентность» химического элемента в соединении. На протяжении многих десятилетий в учебно-методической литературе использовалось следующее определение понятия «эквивалент»: «Эквивалент (Э) – это такое весовое количество вещества, которое в определенной химической реакции может замещать или присоединять 1 весовую часть водорода или 8 весовых частей кислорода». С развитием химической науки, переходу к молярным величинам возникла необходимость расширить и унифицировать понятие «эквивалент». Итак: * Эквивалент – это реальная или условная химическая частица, которая в реакциях разных типов равноценна атому или иону гидрогена (Н, Н+, Н-). * Z – эквивалентное число.
Для веществ молекулярного строения эквивалентное число показывает, сколько атомов водорода могут гипотетически заменить данную молекулу или химический элемент в составе молекулы. - Эквивалентное число химического элемента в соединении равно числу единиц валентности, связывающих его с другими атомами. - Эквивалентное число молекулы равно числу связывающих электронов.
Таблица 1. Понятие «эквивалент» в простых веществах
Для веществ ионного строения эквивалентное число равно суммарному заряду катионов или анионов в формульной единице вещества: Na+Cl- Z = 1, Ca2+Cl-2 Z = 2, Al3+(NO3)-3 Z = 3, Mg2+3(PO4)3-2 Z = 6.
* f - фактор эквивалентности – величина, обратная эквивалентному числу: f = 1/ Z. Это число, показывающее, какая часть реальной химической частицы равноценна одному атому или иону водорода.
* nf – количество вещества эквивалента – такое количество элементарных химических частиц, которое равноценно: - 1 моль ионов водорода в реакциях замещения, кислотно – основного взаимодействия или ионного обмена, - 1 моль единиц валентности, - 1 моль электронов в окислительно – восстановительных реакциях. nf = f × n * Mf - молярная масса эквивалента вещества (понятие «эквивалент» в первоначальном определении) – масса 1 моль эквивалентов вещества: Mf = f × М
Способы расчета молярной массы эквивалента (Mf) в ионных соединениях Молярная масса эквивалента ионного соединения может быть определена двумя способами: 1. Как произведение молярной массы формульной единицы вещества на фактор эквивалентности: Mf = f × М 2. Как сумма молярных масс эквивалентов катиона и аниона:
Второй способ удобнее и проще осуществлять табличным способом:
Упражнения для самостоятельного решения 7. Рассчитайте двумя способами молярную массу эквивалента для 8. Рассчитайте молярные массы эквивалента перечисленных соединений, исходя из их молярных масс: 9. Чему равен фактор эквивалентности воды при ее взаимодействии: а) с оксидом натрия, б) с металлическим натрием? 10. Одинаков ли эквивалент металла в двух соединениях:
*Закон эквивалентов: «Эквивалентные количества всех веществ, участвующих в реакции одинаковы»: Для реакции А + В = С nf(A) = nf(B) = nf(C) или m(A): m(B): m(C) = Mf (A): Mf (B): Mf (C) Этот закон лег в основу практических методов определения эквивалентов, атомных и молярных масс. 1. Метод прямого определения молярной массы эквивалента вещества Пример 1. При сжигании 2,28 г металла получено 3,78 г его оксида. Найти молярную массу эквивалента вещества Mf. Решение: Находим массу кислорода, пошедшего на окисление металла:
Далее из пропорции, согласно закону эквивалентов, находим эквивалент металла:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 469; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.224.223 (0.008 с.) |

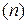 пропорционально числу конкретно указанных элементарных химических частиц. Коэффициент пропорциональности – постоянная величина (постоянная Авогадро):
пропорционально числу конкретно указанных элементарных химических частиц. Коэффициент пропорциональности – постоянная величина (постоянная Авогадро):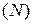 , массой
, массой 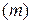 , объемом при нормальных условиях
, объемом при нормальных условиях 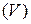 и количеством вещества
и количеством вещества 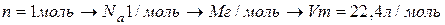
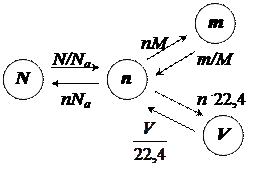
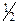
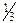
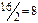
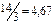
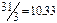
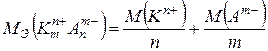
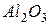 ,
, 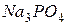 ,
, 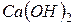 ,
, 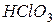 .
.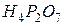 ,
, 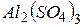 ,
, 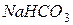 ,
, 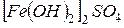 ,
, 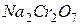 .
.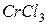 и
и 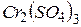 ;
; 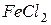 и
и 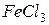 ?
?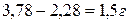
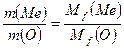 , где
, где 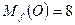 г/моль.
г/моль.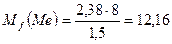 г/моль.
г/моль.


