Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диагностическое корректирующее тестирование по теме «Химическое равновесие»Содержание книги
Поиск на нашем сайте
2. Задание для самостоятельной работы по теме «Химическое равновесие». (Обязательный минимальный уровень)
Даны схемы обратимых реакций (а – г) с указанием термохимического теплового эффекта. 1. Запишите выражения для концентрационной константы равновесия каждой реакции. 2. Запишите выражение константы равновесия реакции (в), выраженное через парциальные давления. 3. Укажите условия, при которых равновесие реакций (б) смещается вправо. 4. В какой из реакций изменение давления не влияет на состояние равновесия? 5. Как сместится равновесие реакции (a), если: а) ↓р; б) ↑Т; в) использовать катализатор; г) ввести в реакционную смесь He при const р. 6. Для каких реакций одновременное ↓Т и ↑р ведет к смещению равновесия в одном направлении? 7. В реакции (а) равновесие наступило, когда концентрации всех веществ сотавили 2 моль/л. Каковы были исходные концентрации? Задание для расчетной контрольной работы 1. Рассчитайте равновесный выход продукта реакции 3О2(г) ↔ 2О3(г), если известны начальная масса и равновесное количество вещества О2.
2. Рассчитайте константу равновесия реакции 3А(г) + 4В(г) ↔ С(г) + 2D(г), если при постоянной температуре известны равновесные концентрации веществ (моль/л).
3. По следующим данным при постоянной температуре для реакции 2NF3(г) + 3H2(г)↔ 6 HF(г) + N2(г) определите равновесные концентрации фтороводорода и начальные концентрации (моль/л) реагентов.
4. Даны гомогенные реакции. Заданы константы равновесия и начальные концентрации, одинаковые для обоих реагентов. Определите равновесные концентрации всех веществ (моль/л).
Опорный конспект №7. Тема:«Ионное произведение воды. Водородный показатель рН» Самоионизация молекул воды или реакция диссоциации – равновесный процесс - описывается уравнением: 2 Н2О ↔ Н3О+ + ОН- (Упрощенно: Н2О ↔ Н+ + ОН-) Константа равновесия реакции диссоциации при 220С:
В 1 л воды содержится n(Н2О) =1000/18 = 55,56 моль. Это значительно больше концентраций ионов гидроксила и водорода. Константа воды или ионное произведение воды – выражение: КW = К [H2O] = [H+][OH-]; КW(220С) = 1,8×10-16 × 55,56 = 1×10-14 Следовательно, [H+] = [OH-] = 1×10-7 Водородным показателем является выражение: рН = -lg[H3O+] (Упрощенно: рН = -lg[H+]). По аналогии: рОН = -lg[OН-] Таким образом, в чистой воде (нейтральная среда) имеем соотношения: рН = рОН =7, рН + рОН = 14 100 Кислая среда 10-7 Щелочная среда 10- 14 [ H3O+],моль/л РН 1. рН разбавленных растворов сильных кислот (с < 0,05 моль/л): Разбавленные растворы сильных кислот диссоциированы нацело: НА = Н+ + А-, поэтому [H+] = С(НА) и рН = - lg С(НА) 2. рН растворов слабых кислот и оснований: Диссоциация слабых кислот – обратимый процесс: НА ↔ Н+ + А- Начальные концентрации, моль/л: С 0 0 Равновесные - С(1-α) αС αС α – степень диссоциации – отношения числа диссоциированных молекул к общему числу взятых молекул. Константа диссоциации Подставив равновесные значения, имеем:
В состоянии равновесия [H+] = [A-], откуда легко вывести соотношения: 1) 2) 3)
Задачи для самостоятельного решения 1. Установите связь между константой и степенью диссоциации слабой кислоты (выведите закон разведения Оствальда) при концентрации раствора С моль/л. 2. Во сколько раз необходимо разбавить раствор слабого электролита АВ, чтобы удвоить степень его диссоциации? 3. Как изменится рН раствора при добавлении к нему равного объема воды? 4. Во сколько раз необходимо увеличить или уменьшить концентрацию водородных ионов, чтобы рН раствора: а) увеличилась на единицу; б) уменьшилась на 2 единицы? 5. Для каких электролитов разбавление их растворов в 10 раз приводит к повышению рН на единицу? 6. Для каких электролитов разбавление их растворов в 10 раз приводит к понижению рН на единицу? 7. В раствор КОН добавлено некоторое количество хлорида аммония. Изменится ли рН раствора и как? 8. Число ионов водорода в растворе в 100 раз больше, чем ионов гидроксила. Чему равен рН раствора? 9. Покажите, что рН водного раствора слабой одноосновной кислоты НА равен: рН = ½ (рК + рСК), где рСК = -lgС(кислоты).
10.Покажите, что рН водного раствора натриевой соли слабой одноосновной кислоты НА равен: РН = 7 + ½ (рК – рС(соли)).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 321; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.219.123 (0.011 с.) |


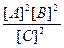



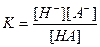
 - закон разведения Оствальда
- закон разведения Оствальда
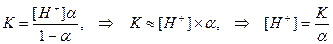 (при значениях α << 1)
(при значениях α << 1)