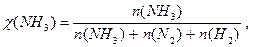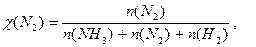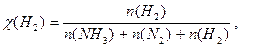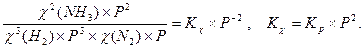Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опорный конспект №6. Тема: «Химическое равновесие»
Реакции, идущие одновременно в двух противоположных направлениях называются обратимыми. Равновесие может осуществляться только в замкнутой системе, содержащей постоянное количество вещества при постоянной температуре. При равновесии микроскопические процессы продолжаются, но они взаимно уравновешены, следовательно, макроскопических изменений не наблюдается. Химические реакции протекают самопроизвольно в направлении достижения равновесия. При этом состояние равновесия определяется одновременно двумя факторами – минимальной энергией и максимальной беспорядочностью движения. В равновесных условиях скорость прямой реакции равна скорости обратной реакции. Для реакции aA + bB ↔ cC + dD Константа равновесия химической реакции, выраженная через молярные концентрации исходных и конечных веществ, является математическим выражением закона действия масс Гульдберга и Вааге:
При КС>>1 реакция идет глубоко, при КС<<1 выход ничтожно мал. Для реакций, протекающих в газовой фазе, константа равновесия записывается через парциальные давления реагирующих веществ Кр. Обе константы связаны между собой уравнением: Кр = Кс(RT)Δn, где Δn = (с + d) – (a + b) – разность между числом молей газообразных продуктов реакции и числом молей газообразных исходных веществ. При Δn =1 Кс = Кр/ RT. Пример 1. Для реакции 2СО2 ↔ 2СО + О2 при 2000оС состав равновесной смеси в объемных долях (φ%) составил: 85,2 СО2, 9,9 СО, 4,9 О2, а общее давление в системе P = 1, 13×105 Па. Найти Кс и КР. Решение: Найдем парциальные давления газов в смеси: pi = P×φi Р(СО2) = 1,013 105×0,852 = 0,863 ×105 Па Р(СО) = 1,013 105×0,099 = 1,100 ×105 Па Р(О2) = 1,013 105 ×0,049 = 0,050 ×105 Па Найдем выражение для константы скорости через парциальные давления:
Δn = 3 -2 =1, следовательно, Кс = Константу равновесия можно выразить через мольные (молярные) доли веществ в реакционной смеси Кχ. Она связана с константой, выраженной через парциальные давления соотношением: Кχ = Кр –Δn. Пример 2. Выведите соотношение между константами равновесия Кс и Кр, а затем Кр и Кχ для реакции 3Н2(г.) + N2(г.) ↔ 2NH 3(г.). Решение: Константа равновесия, выраженная через равновесные концентрации веществ, участвующих в реакции,
[газ] = Константа равновесия, выраженная через мольные доли веществ в реакционной смеси где
Парциальное давление можно выразить через мольную долю вещества и общее давление смеси Р: р(NH 3) = χ(NH 3) × Р, р(Н2) = χ(Н2) × Р, р(N2) = χ(N2) × Р, причем Р = р(NH 3) + р(Н2) + р(N2).
Упражнение. Запишите выражение, связывающее константу Кр и степень диссоциации водяного пара α для реакции: 2Н2О(г.) ↔ 2Н2(г.) + О2(г.) при Р = const.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 394; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.33.41 (0.006 с.) |
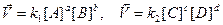 .
.
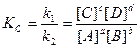
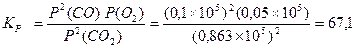
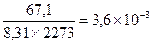 моль/м3.
моль/м3.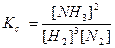 . Константа равновесия, выраженная через парциальные давления газообразных веществ,
. Константа равновесия, выраженная через парциальные давления газообразных веществ, 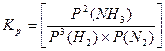 равн. Концентрацию газа можно выразить через его давление при помощи уравнения состояния идеального газа: PV = nRT. Из этого уравнения следует:
равн. Концентрацию газа можно выразить через его давление при помощи уравнения состояния идеального газа: PV = nRT. Из этого уравнения следует: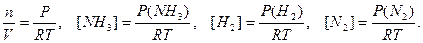
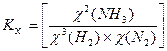 равн.,
равн.,