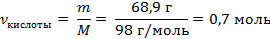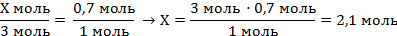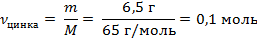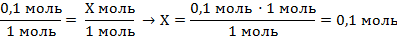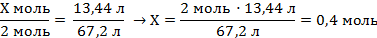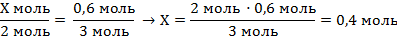| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
| на нахождение массы вещества
|
| метод пропорций
|
| 1.Прочитайте текст задачи.
| Какая масса гидроксида натрия необходима для реакции с 68,6 г ортофосфорной кислоты с образованием средней соли?
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
m (H3PO4) = 68,6 г
m (NaOH) =?
|
| 3. Запишите уравнение реакции
| 3.Решение:
3NaOH + H3PO4 = Na3PO4 + 3H2O
|
| 4. Над формулами записать, что известно по условию задачи
| Х г 68,6 г
3NaOH + H3PO4 = Na3PO4 + 3H2O
|
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (находим массы гидроксида натрия и ортофосфорной кислоты). (ν – коэффициенты перед соответствующими веществами)
| Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40
M (NaOH) = 40 г/моль
m (NaOH) = ν · M = 3 моль · 40 г/моль = 120 г
Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98
M (H3PO4) = 98 г/моль
m (H3PO4) = ν · M = 1 моль · 98 г/моль = 98 г
Х г 68,6 г
3NaOH + H3PO4 = Na3PO4 + 3H2O
120 г 98 г
|
| 6. Составляем пропорцию и производим расчёт
| 
|
| количественный метод
|
| выполнить пункты 1 - 3
|
|
| 4. Рассчитать молярные массы гидроксида натрия и ортофосфорной кислоты
| Mr (NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40
M (NaOH) = 40 г/моль
Mr (H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98
M (H3PO4) = 98 г/моль
|
| 5. Рассчитать количество ортофосфорной кислоты по формуле
| 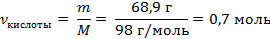
|
| 6. Записать в уравнении данные по условию уравнения и полученные величины над формулами, под формулам - количество данных веществ (ν – коэффициенты перед соответствующими веществами)
| Х моль 0,7 моль
3NaOH + H3PO4 = Na3PO4 + 3H2O
3 моль 1 моль
|
| 7. Составить и решить пропорцию
| 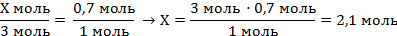
|
| 8. По формуле найти массу гидроксида натрия
| m (NaOH) = ν · M = 2,1 моль · 40 г/моль = 84 г
|
| Записать ответ
| Ответ: m (NaOH) = 84 г
|
| на нахождение объёма вещества
|
| 1.Прочитайте текст задачи.
| Какой объём газа выделится при взаимодействии 6,5 г цинка с избытком раствора серной кислоты?
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
m (Zn) = 6,5 г
V(Н2) =?
|
| 3. Запишите уравнение реакции
| 3.Решение:
Zn + H2SO4 = ZnSO4 + H2↑
|
| 4. Над формулами записать, что известно по условию задачи
| 6,5 г Х л
Zn + H2SO4 = ZnSO4 + H2↑
|
| 5. Вычислить массу цинка и объём водорода по уравнению реакции
| Mr (Zn) = Ar(Zn) = 65
M (Zn) = 65 г/моль
m (Zn) = ν · M = 1 моль · 65 г/моль = 65 г
V = ν · Vm = 1 моль · 22,4 л/моль = 22,4 л
|
| 6. Полученные величины записать под соответствующими формулами
| 6,5 г Х л
Zn + H2SO4 = ZnSO4 + H2↑
65 г 22,4 л
|
| 7. Составить и решить пропорцию
| 
|
| количественный метод
|
| выполнить 1 – 3
|
|
| 4. Рассчитать количество цинка
| Mr (Zn) = Ar(Zn) = 65
M (Zn) = 65 г/моль
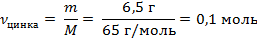
|
| 5. Полученную величину записать в уравнение над формулой цинка, под формулами количество вещества по уравнению реакции (коэффициенты перед формулами)
|
0,1 моль Х моль
Zn + H2SO4 = ZnSO4 + H2↑
1 моль 1 моль
|
| 6. Составить пропорцию и решить
| 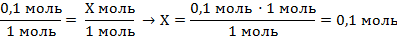
|
| 7. По формуле найти объём выделившегося газа
| Vm = 22,4 л/моль
V = ν · Vm
V(H2) = 0,1 моль · 22,4 л/моль = 2,24 л
|
| Записать ответ
| Отсвет: V(H2) = 2,24 л
|
| на нахождение количества вещества
|
| 1.Прочитайте текст задачи.
| Какое количество вещества алюминия реагировало с избытком соляной кислоты, если в ходе реакции выделилось 13,44 л (н.у.) водорода?
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
V (Н2) = 13,44 л
н.у.
ν (Al) =?
|
| 3. Запишите уравнение реакции
| 3 Решение:
Al + HCl = AlCl3 + H2↑
|
| 4. Над формулами записать, что известно по условию задачи
| Х моль 13,44 л
2Al + 6HCl = 2AlCl3 + 3H2↑
|
| 5. По формуле вычислите объём водорода (по уравнению реакции)
| V = ν · Vm
V(H2) = 3 моль · 22,4 л/моль = 67,2 л
|
| 6. Под формулами записать рассчитанный объём водорода и количество алюминия по уравнению реакции (коэффициент перед формулой)
| Х моль 13,44 л
2Al + 6HCl = 2AlCl3 + 3H2↑
2 моль 67,2 л
|
| 7. Составить пропорцию и решить
| 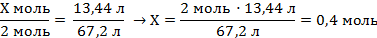
|
| количественный метод
|
| выполнить пункты 1 - 3
|
|
| 4. Рассчитать количество водорода
| 
|
| 5. Над формулами записать, что известно и что надо найти
| Х моль 0,6 моль
2Al + 6HCl = 2AlCl3 + 3H2↑
|
| 6. Под формулами записать количество водорода и количество алюминия по уравнению реакции (коэффициент перед формулой)
| Х моль 0,6 моль
2Al + 6HCl = 2AlCl3 + 3H2↑
2 моль 3 моль
|
| 7. Составить пропорцию и решить
| 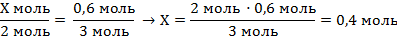
|
| Записать ответ
| Ответ: ν (Al) = 0,4 моль
|