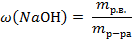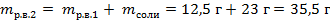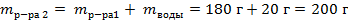| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
|
| расчёт массовой доли растворённого вещества
|
| 1.Прочитайте текст задачи.
| Рассчитать массовую долю хлорида натрия в растворе, полученном при смешивании 28г соли и 252г воды.
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mсоли = 28 г
mводы = 252 г
ω (NaCl) =?
|
| 3. Рассчитать массу раствора
| 3.Решение:
mраствора = mсоли + mводы
mраствора = 28 г + 252 г = 280 г
|
| 4. По формуле рассчитать массовую долю растворённого вещества
| 
|
| 5 Записать ответ
| Ответ: 
|
| вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества (приготовление растворов)
|
| 1.Прочитайте текст задачи.
| Вычислите массы гидроксида натрия и воды, необходимых для приготовления 400 г 20%-го раствора гидроксида натрия
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mр-ра = 400 г
ω (NaОН) = 20% = 0,2
m(NaOH) =?
mводы =?
|
| 3. Рассчитать массу гидроксида натрия в растворе (растворённое вещество)
| 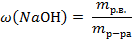

|
| 4. Рассчитайте массу воды
| mраствора = mсоли + mводы
mводы = mраствора - mсоли
mводы = 400 – 80 = 320 г
|
| Записать ответ
| Ответ: mводы = 320 г; m(NaOH) = 80 г
|
| решение задач на упаривание раствора
|
| при упаривании испаряется растворитель, а масса растворённого вещества остаётся неизменной; концентрация раствора увеличивается
|
| 1.Прочитайте текст задачи.
| 100 г 25%-ного раствора соли упарили до 80 г. Вычислите массовую долю растворённого вещества в полученном растворе
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mр-ра 1 = 100 г
mр-ра 2 = 80 г
ω1 = 25% или 0,25
ω2 =?
|
| 3. Вычислить массу растворённого вещества в первом растворе по формуле
| 

|
| 4. Вычислить массовую долю вещества во втором растворе
| 

|
| 5.Записать ответ
| Ответ: ω2 = 0,3125 или 31,25%
|
| решение задач на концентрирование раствора
|
| при концентрировании в раствор добавляется дополнительная масса растворённого вещества; концентрация повышается
|
| 1.Прочитайте текст задачи.
| К 250 г 5%-ного раствора соли добавили 23 г соли. Вычислите массовую долю полученного раствора
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mр-ра 1 = 250 г
mсоли = 23 г
ω1 = 5% или 0,05
ω2 =?
|
| 3. Вычислить массу растворённого вещества в первом растворе по формуле
| 

|
| 4. Вычислить массу растворённого вещества по формуле
| 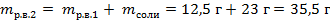
|
| 5. Вычислить массу полученного раствора по формуле
| 
|
| 6. Вычислить массовую долю вещества во втором растворе
| 

|
| 7.Записать ответ
| Ответ: ω2 = 0,1243 или 12,43%
|
| решение задач на разбавление раствора
|
| к раствору добавляется определённая масса растворителя; концентрация уменьшается
|
| 1.Прочитайте текст задачи.
| К 180 г 10% - ного раствора кислоты добавили 20 г воды. Вычислите массовую долю полученного раствора
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mр-ра 1 = 180 г
mводы = 20 г
ω1 = 10% или 0,1
ω2 =?
|
| 3. Вычислить массу растворённого вещества в первом растворе по формуле
| 

|
| 4. Вычислить массу полученного раствора по формуле
| 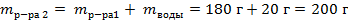
|
| 5. Вычислить массовую долю вещества во втором растворе
| 

|
| 6. Записать ответ
| Ответ: ω2 = 0,09 или 9%
|
| решение задач на смешивание растворов
|
| 1.Прочитайте текст задачи.
| К 230 г 30%-ного раствора щёлочи добавили 100 г 6%- ного раствора щёлочи. Вычислите массовую долю полученного раствора
|
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
mр-ра 1 = 230 г
ω1 = 30% или 0,3
m р-ра 2 = 100 г
ω2 = 6% или 0,06
ω3 =?
|
| 3. Вычислить массы растворённого вещества в растворах по формуле
| 



|
| 4. Вычислить массу полученного раствора по формуле
| 
|
| 5. Вычислить массовую долю вещества в полученном растворе
| 

|
| 6. Записать ответ
| Ответ: ω3 = 0,227 или 22,7%
|