

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Физические величины, используемые при решении задач
Похожие статьи вашей тематики
| наименование величины
| обозначение
| единица измерения
| пример формы записи
| можно найти по формулам
| | масса вещества
| m
| мг; г; кг
| m (H2O) = 15 г
| m= М· ν
m= ρ · М
m= N/ NA · М
m= V/ Vm· М
mраств. в-ва= ω · mраствора
mраствора = mраств. в-ва/ ω
m = V · ρ
| | относительная атомная масса
| Ar
| безразмерная
| Ar (C) = 12
| Ar смотрим в таблице Менделеева
| | относительная молекулярная масса
| Mr
| безразмерная
| Mr(H2O) = 18
| Mr(H2O) = 2 Ar(H) + Ar(O) = 2 · 1 + 16 = 18
| | количество вещества
| ν(ню) или
n
| моль
| ν(CH4) = 1,2 моль
| ν = m/ М
ν = V/ Vm
ν = N/ NA
| | молярная масса (численно равна относительной молекулярной масса)
| М
| г/моль; кг/моль
| M(H2O) =18г/моль
| М = m/ ν
| | объём вещества (1 моль любого газа при нормальных условиях занимает 22,4 л)
| V
| мл; л; м3
| V(O2) = 10 л
| V = Vm· ν
V=(m/ М) · Vm
V = m/ ρ
| | молярный объём (нормальные условия)
| Vm
| л/моль; м3/моль
| Vm= 22,4 л/моль
| Vm= V/ ν
Vm= М/ ρ
Vm= V· (М/ m)
| | плотность вещества
| ρ(ро)
| г/мл; г/см3; кг/м3
| ρ(H2O) = 1 г/мл
| ρ = m/ V
ρ = М/ Vm
ρгаза = Мгаза/ Vm
| | относительная плотность
| D
| безразмерная
| D H2 = 16
| Dгаза по H2 = Мгаза/ 2 г/моль
Dгаза по воздуху = Мгаза/ 29 г/моль
| | массовая доля вещества в растворе или в смеси
| ω(омега)
| безразмерная или в %
| ω (С) = 0,45 или 45%
| ω = mраств. в-ва/ mраствора
| | массовая доля элемента в соединении (веществе)
| ω(омега)
| безразмерная или в %
| ω (С) = 0,45 или 45%
| ω = n Ar/ Mr, где n – число атомов элемента в соединении
| | объёмная доля газа в смеси
| φ(фи)
| безразмерная или в %
| φ (H2O) = 0,15 или 15%
| φ = V раств. в-ва/ V раствора
| | массовая доля выхода вещества в реакции
| η(эта)
| безразмерная или в %
| η (СО2) = 0,25 или 25%
| η = mпракт.вых/ mтеор.
η = νпракт.вых/ νтеор.
η = Vпракт.вых/ Vтеор.
| | число Авогадро
| NA
| число частиц (атомов, молекул)
| NA = 6,02 · 1023
| NA = N/ ν
| | число частиц вещества
| N
| атомы, молекулы
| N(NaOH) = 3,01 · 1023
| | | массовая доля чистого вещества
| ω(омега)
| безразмерная или в %
| ω (СО2) = 0,25 или 25%
| ωчист.в-ва = mчист.в-ва/ mсмеси
|
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
| | количественный метод
| | 1.Прочитайте текст задачи.
| 1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей?
| | 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
m(CаO)=?
| | 3.Составьте уравнение химической реакции.
| 3.Решение:
CаСO3 = CаО + СO2
| | 4.Массу чистого вещества (как и объём) можно вычислить двумя способами
1 способ:
ω (чист.вещ-ва)= 100% - ω прим.
ω (чист.вещ-ва) = m (чист.вещества) / m (смеси)
Отсюда:
m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва)
2 способ:
m (примеси) = m (смеси) · ω (примеси)
m (чист.вещества) = m (смеси) - m (примеси)
| 4.Решение:
1 способ:
ω (чист.вещества) CаСO3= 100% - 20% = 80% или 0,8
m (чист.вещества) CаСO3= 400г · 0,8 = 320 г
2 способ:
m (примеси) = 400 г · 0,2 = 80 г
m (чист.вещества) CаСO3= 400 г – 80 г = 320 г
Выбирай понятный для тебя способ решения!
| | 5.В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче.
| 5. CаСO 3 = CаО + СO2
| | 6.Вычислите молярные массы этих веществ.
| 6.
М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль
М(СaO) = 40 + 16 = 56 г/моль
| | 7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М
| 7. ν (CаСO3)= 320 г/100 г/моль = 3,2 моль
| | 8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, - показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Хмоль.
| 8. 3,2 моль Хмоль
CаСO 3 = CаО + СO2
| | 9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) - показывают необходимые количества исходного и образующегося веществ.
|
9. 3,2 моль Хмоль
CаСO 3 = CаО + СO2
1моль 1моль
| | 10.Составить и решить пропорцию.
| 10.
3,2 моль Х моль Х = 3,2 моль · 1 моль = 3,2 моль
D cKkCHqQFdK7SZUJ+LtPlZrFZ5JN8Ot9M8rSuJ4/bKp/Mt9n9rP5UV1Wd/QrUsrzoBGNcBXbjtGb5 303DdW8uc3ab11sZkrfosV5AdvxH0rGvoZWXodhrdt7Zsd8woNH4ukxhA17fQX698uvfAAAA//8D AFBLAwQUAAYACAAAACEAP5AJCtwAAAAIAQAADwAAAGRycy9kb3ducmV2LnhtbEyPwU7DMBBE70j8 g7VIvSBqJ6hAQ5yqqsSBI20lrm68JIF4HcVOE/r1bNVDOe7MaPZNvppcK47Yh8aThmSuQCCV3jZU adjv3h5eQIRoyJrWE2r4xQCr4vYmN5n1I33gcRsrwSUUMqOhjrHLpAxljc6Eue+Q2PvyvTORz76S tjcjl7tWpko9SWca4g+16XBTY/mzHZwGDMMiUeulq/bvp/H+Mz19j91O69ndtH4FEXGK1zCc8Rkd CmY6+IFsEK2G5eMzJ1lXCxBnXyUpiMNFkEUu/w8o/gAAAP//AwBQSwECLQAUAAYACAAAACEAtoM4 kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQABgAI AAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQABgAI AAAAIQCOhH+bGwIAADoEAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQItABQA BgAIAAAAIQA/kAkK3AAAAAgBAAAPAAAAAAAAAAAAAAAAAHUEAABkcnMvZG93bnJldi54bWxQSwUG AAAAAAQABADzAAAAfgUAAAAA "/>1 моль 1 моль 1 моль
ν (CаО) = 3,2 моль.
| | 11.Вычислите массу продукта реакции
m(вещества)= ν(вещества) · М(вещества)
| 11.
m(СаО) =3,2 моль · 56 г/моль = 179,2 г
| | 12.Запишите ответ.
| 12.Ответ:
m(CаО) = 179,2 г.
| | метод пропорций
| | 1. Повторить действия пунктов 1 – 6 количественного метода
|
| | 2. По формуле m= М · ν(где ν –коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества
| m= М · ν
m(CаСO3) = 100 г/моль · 1 моль = 100 г
m(СaO) = 56 г/моль · 1 моль = 56 г
| | 3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Хг
| 3.
320 г Хг
CаСO 3 = CаО + СO2
| | 4. Под соответствующей формулой записать массу, полученную в пункте 3
| 4.
320 г Хг
CаСO 3 = CаО + СO2
100 г 56 г
| | 5. Составить и решить пропорцию
| 5.
320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
| | 6.Запишите ответ.
| 6.Ответ:
m(CаО) = 179,2 г.
|
Алгоритм определения массовой доли элемента в соединении
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
| | 1.Прочитайте текст задачи.
| Вычислите массовую долю кислорода в перманганате калия.
| | 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
KMnO4
ω (О)=?
| | 3.Найдите молекулярную массу перманганата калия KMnO4
| 3.Решение:
Mr(KMnO4) = Ar(K) + Ar(Mn) + 4Ar(O) = 39 + 55 + 4 · 16 = 142
| 4. По формуле  рассчитайте массовую долю кислорода в соединении рассчитайте массовую долю кислорода в соединении
| 4. 

| | 5.Запишите ответ.
| Ответ: 
| Алгоритм определения массовых соотношений элементов в соединении
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
| | 1.Прочитайте текст задачи.
| Определить массовые соотношения железа и кислорода в оксиде железа (III)
| | 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
Fe2O3
E yIsNxaUKeNAY0LlaF5H8XKbLzWKzmI6mk/lmNE2ravS4Laej+Ta7n1V3VVlW2a9ALZvmrWCMq8Bu EGw2/TtBXJ/ORWo3yd7GkLxHj/MCssN/JB03G5Z5kcVes/PODhsHjcbg63sKj+DtHey3r379GwAA //8DAFBLAwQUAAYACAAAACEA8ejJE9kAAAAFAQAADwAAAGRycy9kb3ducmV2LnhtbEyOQUvDQBSE 74L/YXmCF7GbBqxtzKYUwYNH24LX1+wzSZt9G7KbJvbX++pFbzPMMPPl68m16kx9aDwbmM8SUMSl tw1XBva7t8clqBCRLbaeycA3BVgXtzc5ZtaP/EHnbayUjHDI0EAdY5dpHcqaHIaZ74gl+/K9wyi2 r7TtcZRx1+o0SRbaYcPyUGNHrzWVp+3gDFAYnubJZuWq/ftlfPhML8ex2xlzfzdtXkBFmuJfGa74 gg6FMB38wDao1sDqWYoGFimoa7pMRRx+vS5y/Z+++AEAAP//AwBQSwECLQAUAAYACAAAACEAtoM4 kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQABgAI AAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQABgAI AAAAIQDAo++kHgIAAD0EAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQItABQA BgAIAAAAIQDx6MkT2QAAAAUBAAAPAAAAAAAAAAAAAAAAAHgEAABkcnMvZG93bnJldi54bWxQSwUG AAAAAAQABADzAAAAfgUAAAAA "/>
| | 3.Найдите относительную молекулярную массу оксида железа (III)
| 3.Решение:
Mr(Fe2O3) = 2Ar(Fe) + 3Ar(O) = 2 · 56 + 3 · 16 = 112 + 48
| | 4. Вычислите простейшие массовые отношения, для чего сократите массы элементов на одно и то же число.
| 4.  → 28: 12 → → 28: 12 → 
| | 5.Запишите ответ.
| Ответ: В оксиде железа (III) на 7 г атомов железа приходится 3 г атомов кислорода
| Алгоритм определения молекулярной формулы вещества по массовым соотношениям элементов
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
| ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ
| | 1.Прочитайте текст задачи.
| Химическое соединение содержит по массе 17,56% натрия, 39,69% хрома и 42,75% кислорода. Определите простейшую формулу соединения
| | 2.Запишите условие и требование задачи с помощью общепринятых обозначений.
| 2.Дано:
 (Na) = 17,56% (Na) = 17,56%
 (Cr) = 39,69% (Cr) = 39,69%
 (O) = 42,75%
6 Ynsi5NmG4lIFPGgM6Fyss0h+LNLFer6e56N8MluP8rSuR8+bKh/NNtnjtH6oq6rOfgZqWV50gjGu ArurYLP87wRxeTpnqd0kextD8h49zgvIXv8j6bjZsMyzLHaanbb2unHQaAy+vKfwCO7vYN+/+tUv AAAA//8DAFBLAwQUAAYACAAAACEA8ejJE9kAAAAFAQAADwAAAGRycy9kb3ducmV2LnhtbEyOQUvD QBSE74L/YXmCF7GbBqxtzKYUwYNH24LX1+wzSZt9G7KbJvbX++pFbzPMMPPl68m16kx9aDwbmM8S UMSltw1XBva7t8clqBCRLbaeycA3BVgXtzc5ZtaP/EHnbayUjHDI0EAdY5dpHcqaHIaZ74gl+/K9 wyi2r7TtcZRx1+o0SRbaYcPyUGNHrzWVp+3gDFAYnubJZuWq/ftlfPhML8ex2xlzfzdtXkBFmuJf Ga74gg6FMB38wDao1sDqWYoGFimoa7pMRRx+vS5y/Z+++AEAAP//AwBQSwECLQAUAAYACAAAACEA toM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQA BgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQA BgAIAAAAIQDDudXaIQIAAD0EAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQIt ABQABgAIAAAAIQDx6MkT2QAAAAUBAAAPAAAAAAAAAAAAAAAAAHsEAABkcnMvZG93bnJldi54bWxQ SwUGAAAAAAQABADzAAAAgQUAAAAA "/>
NaxCryOz =? (O) = 42,75%
6 Ynsi5NmG4lIFPGgM6Fyss0h+LNLFer6e56N8MluP8rSuR8+bKh/NNtnjtH6oq6rOfgZqWV50gjGu ArurYLP87wRxeTpnqd0kextD8h49zgvIXv8j6bjZsMyzLHaanbb2unHQaAy+vKfwCO7vYN+/+tUv AAAA//8DAFBLAwQUAAYACAAAACEA8ejJE9kAAAAFAQAADwAAAGRycy9kb3ducmV2LnhtbEyOQUvD QBSE74L/YXmCF7GbBqxtzKYUwYNH24LX1+wzSZt9G7KbJvbX++pFbzPMMPPl68m16kx9aDwbmM8S UMSltw1XBva7t8clqBCRLbaeycA3BVgXtzc5ZtaP/EHnbayUjHDI0EAdY5dpHcqaHIaZ74gl+/K9 wyi2r7TtcZRx1+o0SRbaYcPyUGNHrzWVp+3gDFAYnubJZuWq/ftlfPhML8ex2xlzfzdtXkBFmuJf Ga74gg6FMB38wDao1sDqWYoGFimoa7pMRRx+vS5y/Z+++AEAAP//AwBQSwECLQAUAAYACAAAACEA toM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQA BgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQA BgAIAAAAIQDDudXaIQIAAD0EAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQIt ABQABgAIAAAAIQDx6MkT2QAAAAUBAAAPAAAAAAAAAAAAAAAAAHsEAABkcnMvZG93bnJldi54bWxQ SwUGAAAAAAQABADzAAAAgQUAAAAA "/>
NaxCryOz =?
| | 3.Запишите относительные атомные массы для каждого элемента
| 3.Решение:
Ar(Na) = 23
Ar(Cr) = 52
Ar(O) = 16
| | 4. Составьте пропорции соотношения массовой доли элемента к его относительной атомной массе
| 4. 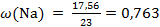

 x: y: z = 0,763: 0,763: 2,672 = 1: 1: 3,5
x: y: z = 0,763: 0,763: 2,672 = 1: 1: 3,5
| | 5. Если получается десятичная дробь, то необходимо избавиться от десятичной дроби. Для этого полученные цифры увеличиваем в 2 раза
| x: y: z = 2·1: 2·1: 2·3,5 = 2: 2: 7
| | 6.Запишите ответ.
| Ответ: Простейшая формула вещества Na2Cr2O7
|
|



 рассчитайте массовую долю кислорода в соединении
рассчитайте массовую долю кислорода в соединении



 → 28: 12 →
→ 28: 12 → 
 (Na) = 17,56%
(Na) = 17,56%
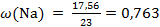

 x: y: z = 0,763: 0,763: 2,672 = 1: 1: 3,5
x: y: z = 0,763: 0,763: 2,672 = 1: 1: 3,5



